Diagram Fasa Air 4q6k6x
This document was ed by and they confirmed that they have the permission to share it. If you are author or own the copyright of this book, please report to us by using this report form. Report 2z6p3t
Overview 5o1f4z
& View Diagram Fasa Air as PDF for free.
More details 6z3438
- Words: 781
- Pages: 5
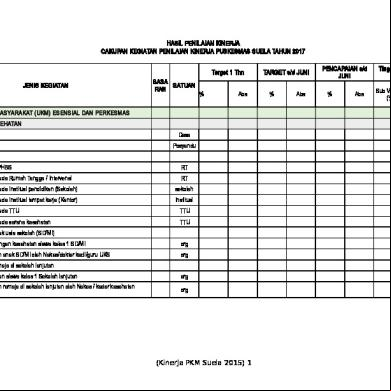
MEATALURGI FISIK
DI SUSUN OLEH: ZULFIKAR 140102039 TEKNIK MESIN FAKULTAS TEKNIK
UNIVERSITAS MUHAMADIYAH RIAU TP 2015/2016
Diagram Fasa Air, Sifat Koligatif Larutan, Rumus, Pengertian, Gambar Grafik, Kimia Diagram Fasa Air, Sifat Koligatif Larutan, Rumus, Pengertian, Gambar Grafik, Kimia Diagram fasa adalah ungkapan perubahan keadaan dasar fasa suatu zat dalam bentuk diagram. Diagram fasa dapat dinyatakan berdasarkan perubahan suhu (°C) dan tekanan (atm), dinamakan diagram P – T. Dalam diagram fasa terdapat kurva kesetimbangan antara fasa padat, cair, dan gas. 1. Diagram Fasa Air Seperti Anda ketahui, air dapat berada dalam fasa gas, cair, dan padat bergantung pada suhu dan tekanan. Ketiga fasa tersebut dapat diungkapkan dalam bentuk diagram P – T (Gambar 1).
Gambar 1. Diagram fasa air Titik tripel A (0,01 °C; 0,006 atm), titik leleh (atau titik beku) normal B (0 °C; 1 atm); titik didih normal C (100 °C; 1 atm), dan titik kritis D (374,4 °C; 217,7 atm). Pada diagram fasa tersebut terdapat tiga kurva yang membagi diagram ke dalam daerah padat, cair, dan gas. Pada setiap daerah, menunjukkan keadaan wujud zat yang stabil. Setiap titik pada kurva menunjukkan hubungan tekanan dan suhu. Kurva AB yang membagi wilayah padat dan cair, menyatakan keadaan padat dan cair berada dalam keadaan setimbang: Padat D Cair Kurva tersebut memberikan informasi tentang titik leleh padatan atau titik beku cairan pada suhu dan tekanan tertentu. Umumnya peleburan (padat → cair) atau pembekuan (cair → padat) tidak dipengaruhi oleh tekanan sehingga kurva AB cenderung membentuk garis lurus.
Kurva AB untuk air agak miring ke kiri karena pembentukan es pada tekanan tinggi suhunya turun sebesar 1 °C dari keadaan normal (1 atm). Hal ini disebabkan pada keadaan cair kurang rapat dibandingkan pada keadaan padat. Kurva AC yang membagi wilayah cair dan gas memberikan informasi tentang tekanan uap air pada berbagai suhu. Kurva tersebut menunjukkan garis kesetimbangan fasa antara cair dan gas. Titik leleh dan titik didih air pada tekanan 1 atm ditunjukkan dengan garis putus-putus, berada pada suhu 0 °C dan 100 °C. Kurva AD yang membagi wilayah padat dan gas memberikan informasi tentang tekanan uap padatan pada berbagai suhu. Kurva tersebut menunjukkan garis kesetimbangan fasa antara padat dan gas. Kurva ini berpotongan dengan kurva yang lain pada titik A. Titik A dinamakan titik tripel, yaitu titik di mana pada suhu dan tekanan tersebut terjadi kesetimbangan fasa antara gas, cair, dan padat secara bersama-sama. Titik tripel untuk air terjadi pada suhu 0,01 °C dan tekanan 0,006 atm (4,58 mmHg). Dengan diagram fasa, Anda dapat memperkirakan wujud suatu zat pada suhu dan tekanan tertentu. Pada tekanan 1 atm dan suhu 25 °C, air akan berwujud cair, sedangkan pada suhu 0 °C air berwujud padat (es). Diagram fasa yang lain misalnya diagram fasa CO2, seperti ditunjukkan pada Gambar 2.
Gambar 2. Diagram fasa karbon dioksida Titik tripel X (–56,4 °C; 5,11 atm), titik sublimasi Y (–78,5 °C; 1 atm), dan titik kritis Z (31,1 °C; 73,0 atm). Titik tripel CO2 berada pada –56,4 °C dan 5,11 atm. Oleh sebab itu, CO2 padat (dry ice) akan menyublim jika dipanaskan di bawah tekanan 5,11 atm. Di atas 5,11 atm, dry ice akan mencair jika dipanaskan. Pada suhu kamar dan tekanan udara normal
dry ice menyublim sehingga sifat ini sering dimanfaatkan untuk pertunjukan panggung terbuka, agar di panggung tampak seperti berkabut. Dengan sedikit pemanasan, dry ice langsung menguap seperti asap.
Beberapa istilah fasa transisi: 1.Penguapan : H2O(l) → H2O(g) 2.Pengembunan : H2O(g) → H2O(l) 3.Peleburan : H2O(s) → H2O(l) 4.Pembekuan : H2O(l) →H2O(s) 5.Sublimasi : H2O(s) → H2O(g) 6.Deposisi : H2O(g) → H2O(s) 2. Diagram Fasa dan Sifat Koligatif Diagram fasa dapat digunakan untuk menyatakan sifat koligatif larutan, seperti kenaikan titik didih, penurunan titik beku, dan penurunan tekanan uap. Jika ke dalam air ditambahkan zat non volatil, larutan yang terbentuk akan memiliki titik didih lebih tinggi dibandingkan pelarut murninya. Adapun titik beku larutan akan lebih rendah dibandingkan titik beku pelarut murninya.
Gambar 3. Diagram fasa larutan dalam pelarut air. Perhatikanlah diagram fasa pada Gambar 3. Pada tekanan normal (1 atm), pelarut murni air memiliki titik beku 0 °C (titik C), titik didih 100 °C (titik B), dan tekanan uap (kurva A – B) yang bergantung pada suhu. Adanya zat terlarut nonvolatil mengakibatkan pergeseran posisi kesetimbangan diagram fasa cair-gas.
Titik beku larutan lebih rendah dari titik beku pelarutnya (titik C'), titik didih larutan lebih tinggi dibandingkan titik didih pelarutnya (titik B'), dan tekanan uap turun, ditunjukkan oleh kurva (A' – B'). Demikian pula titik tripel larutan lebih rendah dari titik tripel air murni. Nilai ΔTf dan ΔTb ditunjukkan oleh selisih pergeseran kesetimbangan antara pelarut murni dan larutannya, yaitu: ΔTf = C – C' dan ΔTb = B' – B. Penurunan tekanan uap larutan ditunjukkan oleh selisih garis AB – A'B'.
DI SUSUN OLEH: ZULFIKAR 140102039 TEKNIK MESIN FAKULTAS TEKNIK
UNIVERSITAS MUHAMADIYAH RIAU TP 2015/2016
Diagram Fasa Air, Sifat Koligatif Larutan, Rumus, Pengertian, Gambar Grafik, Kimia Diagram Fasa Air, Sifat Koligatif Larutan, Rumus, Pengertian, Gambar Grafik, Kimia Diagram fasa adalah ungkapan perubahan keadaan dasar fasa suatu zat dalam bentuk diagram. Diagram fasa dapat dinyatakan berdasarkan perubahan suhu (°C) dan tekanan (atm), dinamakan diagram P – T. Dalam diagram fasa terdapat kurva kesetimbangan antara fasa padat, cair, dan gas. 1. Diagram Fasa Air Seperti Anda ketahui, air dapat berada dalam fasa gas, cair, dan padat bergantung pada suhu dan tekanan. Ketiga fasa tersebut dapat diungkapkan dalam bentuk diagram P – T (Gambar 1).
Gambar 1. Diagram fasa air Titik tripel A (0,01 °C; 0,006 atm), titik leleh (atau titik beku) normal B (0 °C; 1 atm); titik didih normal C (100 °C; 1 atm), dan titik kritis D (374,4 °C; 217,7 atm). Pada diagram fasa tersebut terdapat tiga kurva yang membagi diagram ke dalam daerah padat, cair, dan gas. Pada setiap daerah, menunjukkan keadaan wujud zat yang stabil. Setiap titik pada kurva menunjukkan hubungan tekanan dan suhu. Kurva AB yang membagi wilayah padat dan cair, menyatakan keadaan padat dan cair berada dalam keadaan setimbang: Padat D Cair Kurva tersebut memberikan informasi tentang titik leleh padatan atau titik beku cairan pada suhu dan tekanan tertentu. Umumnya peleburan (padat → cair) atau pembekuan (cair → padat) tidak dipengaruhi oleh tekanan sehingga kurva AB cenderung membentuk garis lurus.
Kurva AB untuk air agak miring ke kiri karena pembentukan es pada tekanan tinggi suhunya turun sebesar 1 °C dari keadaan normal (1 atm). Hal ini disebabkan pada keadaan cair kurang rapat dibandingkan pada keadaan padat. Kurva AC yang membagi wilayah cair dan gas memberikan informasi tentang tekanan uap air pada berbagai suhu. Kurva tersebut menunjukkan garis kesetimbangan fasa antara cair dan gas. Titik leleh dan titik didih air pada tekanan 1 atm ditunjukkan dengan garis putus-putus, berada pada suhu 0 °C dan 100 °C. Kurva AD yang membagi wilayah padat dan gas memberikan informasi tentang tekanan uap padatan pada berbagai suhu. Kurva tersebut menunjukkan garis kesetimbangan fasa antara padat dan gas. Kurva ini berpotongan dengan kurva yang lain pada titik A. Titik A dinamakan titik tripel, yaitu titik di mana pada suhu dan tekanan tersebut terjadi kesetimbangan fasa antara gas, cair, dan padat secara bersama-sama. Titik tripel untuk air terjadi pada suhu 0,01 °C dan tekanan 0,006 atm (4,58 mmHg). Dengan diagram fasa, Anda dapat memperkirakan wujud suatu zat pada suhu dan tekanan tertentu. Pada tekanan 1 atm dan suhu 25 °C, air akan berwujud cair, sedangkan pada suhu 0 °C air berwujud padat (es). Diagram fasa yang lain misalnya diagram fasa CO2, seperti ditunjukkan pada Gambar 2.
Gambar 2. Diagram fasa karbon dioksida Titik tripel X (–56,4 °C; 5,11 atm), titik sublimasi Y (–78,5 °C; 1 atm), dan titik kritis Z (31,1 °C; 73,0 atm). Titik tripel CO2 berada pada –56,4 °C dan 5,11 atm. Oleh sebab itu, CO2 padat (dry ice) akan menyublim jika dipanaskan di bawah tekanan 5,11 atm. Di atas 5,11 atm, dry ice akan mencair jika dipanaskan. Pada suhu kamar dan tekanan udara normal
dry ice menyublim sehingga sifat ini sering dimanfaatkan untuk pertunjukan panggung terbuka, agar di panggung tampak seperti berkabut. Dengan sedikit pemanasan, dry ice langsung menguap seperti asap.
Beberapa istilah fasa transisi: 1.Penguapan : H2O(l) → H2O(g) 2.Pengembunan : H2O(g) → H2O(l) 3.Peleburan : H2O(s) → H2O(l) 4.Pembekuan : H2O(l) →H2O(s) 5.Sublimasi : H2O(s) → H2O(g) 6.Deposisi : H2O(g) → H2O(s) 2. Diagram Fasa dan Sifat Koligatif Diagram fasa dapat digunakan untuk menyatakan sifat koligatif larutan, seperti kenaikan titik didih, penurunan titik beku, dan penurunan tekanan uap. Jika ke dalam air ditambahkan zat non volatil, larutan yang terbentuk akan memiliki titik didih lebih tinggi dibandingkan pelarut murninya. Adapun titik beku larutan akan lebih rendah dibandingkan titik beku pelarut murninya.
Gambar 3. Diagram fasa larutan dalam pelarut air. Perhatikanlah diagram fasa pada Gambar 3. Pada tekanan normal (1 atm), pelarut murni air memiliki titik beku 0 °C (titik C), titik didih 100 °C (titik B), dan tekanan uap (kurva A – B) yang bergantung pada suhu. Adanya zat terlarut nonvolatil mengakibatkan pergeseran posisi kesetimbangan diagram fasa cair-gas.
Titik beku larutan lebih rendah dari titik beku pelarutnya (titik C'), titik didih larutan lebih tinggi dibandingkan titik didih pelarutnya (titik B'), dan tekanan uap turun, ditunjukkan oleh kurva (A' – B'). Demikian pula titik tripel larutan lebih rendah dari titik tripel air murni. Nilai ΔTf dan ΔTb ditunjukkan oleh selisih pergeseran kesetimbangan antara pelarut murni dan larutannya, yaitu: ΔTf = C – C' dan ΔTb = B' – B. Penurunan tekanan uap larutan ditunjukkan oleh selisih garis AB – A'B'.