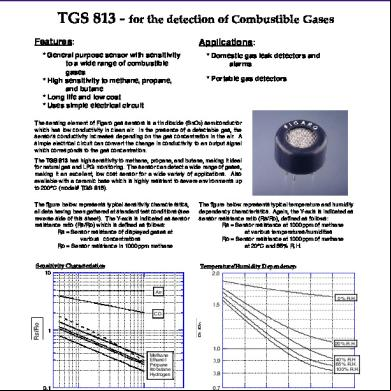
Cours Gaz 2r5529
This document was ed by and they confirmed that they have the permission to share it. If you are author or own the copyright of this book, please report to us by using this report form. Report 2z6p3t
Overview 5o1f4z
& View Cours Gaz as PDF for free.
More details 6z3438
- Words: 8,780
- Pages: 110
بسم هللا الرحمان الرحيم
1
M. BELLAHCENE UFR: Gas, Refining & Petrochemistry
2
Séances Régulières
-Lundi : -Mardi :
13:30 - 16:30 13:30 - 16:30
Lieu : Amphi 5ème Etage
3
Contrôle 02 Examens:
01 mid term 40% 01 examen de synthèse 60%
4
Estimation Des Propriétés Physiques Des Hydrocarbures
5
Références T. H. Ahmed, ‘Hydrocarbon Phase Behavior’ , Contribution in Petroleum Geology & Engineering Vol. 7, Gulf Publishing Company, Huston, 1989.
T. H. Ahmed, ‘Hydrocarbon Phase Behavior’ , Contribution in Petroleum Geology & Engineering Vol. 5, Gulf Publishing Company, Huston, 1989. R. C. Reid, ‘The Properties of Gases and Liquids’ , Third Edition, McGraw Hill, New York, 1977.
J. M. Smith, ‘Introduction to Chemical Engineering Thermodynamics’ , Third Edition, McGraw Hill, New York, 1975. D. L. Katz et al., ‘Handbook of Natural Gas Engineering’ , McGraw Hill, New York, 1959. R. W. Gallant, C. L. Yaws, ‘Physical Properties of Hydrocarbons’ , V.1, Second Edition, Gulf Publishing Company, 1992. Gas Processors Suppliers Association, ‘Engineering Data Book’ , GPSA, 1974. C. U. Ikoku, ‘Natural Gas Engineering’ , PennWell Books, 1980 6
Introduction - Thermodynamique : systèmes fermés / ouverts. - Evolution des Propriétés : due à l’échange avec l’environnement.
- Description d’Etat : en déterminant ses propriétés (T, P, V, yi) - Compilation de données expérimentales de plusieurs espèces -Valeurs de propriétés indisponibles : Théorie, méthode d’estimation ou combination des deux - Equations Empiriques - Parfois inclure l’empiricisme dans des équations existantes telles
a PV nRT P 2 V b RT V
7
Types de Méthodes d’Estimations Une méthode d’estimation Idéal
1 – Donner des résultats physiques et thermodynamiques acceptables pour substances pures et mélanges pour toutes conditions 2 – Indiquer l’état 3 – Requiert peu d’information d’entrée 4 – Précise 5 – Temps de calcul court Methodes d’estimation : pas idéales mais donnent des résulats acceptables. Utiliser méthodes simples lorsque les valeurs approximatives sont acceptées. Preférence de données expérimentales.
8
Loi des Etats Correspondants D’aprés van der Waals
- Les propriétés dépendant des forces intermoléculaires sont liées aux propriétés critiques de la même manière pour tous les composés (Not perfect) - Deux substances sont dites dans des états correspondants quand leurs propriétées réduites sont les mêmes.s mêmes. - La déviation d’un gaz réel par rapport à la loi des gaz parfaits est la même pour différents gaz aux mêmes conditions correspondants de P et T . r
r
- C’est une base importante pour le développement de correlations et méthodes d’estimation. - Plus correcte/précise pour les substances physicochimiquement similaires. 9
AC : Liquide saturé BC : Vapeur saturée
Critical Po int C
Pr essure Liquid
Liquid
Gas
Vapour
T1
A B
T2
Volume Comportement volumétrique d’une substance pure tel que prédit par l’Equation d’Etat (EE) de van der Waals
10
La loi des états correspondants telle qu’appliquée aux propriétés du méthane et l’azote. Valeurs experimentales : ○ Méthane, ● Azote.
11
Courbes d’Equilibre Liquide-Vapeur
12
Propriétés Physiques de Substances Pures
13
Constante des Gaz Parfaits R 8.314 J / ( g mole) K 1.987 cal /( g mole) K
83.14 cm 3 . bar / ( g mole) K 82.05 (cm 3 . atm) /( g mole) K 0.7302 (atm . ft 3 ) /(lb mole) R 10.73 ( psia . ft 3 ) / lb mole) R 1545 ( ft . lb f ) / (lb mole) R 1.987 Btu / (lb mole) R
14
Comportement de Gaz Parfaits Volume des molécules négligeable devant le volume du milieu où elles sont confinées, et pas de forces d’attraction ou de répulsion entre elles.
1. Gaz Purs Loi des gaz parfaits
ou
PV n R T
m PV RT MW
m P MW g V RT 15
2. Mélanges de gaz parfaits
Pm Vm R Tm
Décrits par la loi des gaz parfaits
(m mélange)
Le comportement des mélanges est plus intéressant que celui des corps purs puisque en pratique les gaz existent et/ou sont utilisés le plus souvent sous forme de mélanges de composants d’ydrocarbures.
- fraction molaire
yi
ni n
ni
n
i
i
- fraction massique
wi
mi m
wi
mi
m
ou i
i
- fraction volumique
Vi v V
yi MWi yi MWi i
yi
wi / MWi
(w / MW ) i
i
i
Vi Vi i
16
Exercice 1 Déterminer la composition en fraction massique
Composant
Fraction Molaire y i
C1
0.65
C2
0.10
C3
0.10
C4
0.10
C5
0.05
Exercice 2 Déterminer la composition en fraction molaire
Composant
Fraction Massique wi
C1
0.40
C2
0.10
C3
0.20
C4
0.20
C5
0.10
17
Propriétés de Mélanges Gazeux Parfaits Poids moléculaire Apparent
MWa yi MWi i 1
Volume Standard
(1) R Tsc Vsc Psc
1 mole PSC 14.7 psia (1 atm) TSC 60 F
(15.6 C )
R 10.73 psia . ft 3 . (lb mole) 1 . R 1
1 x 10.73 psia. ft 3 .(lb mole) 1 .R 1 x (60 460) R Vsc 14.7 psia VSC 379.4 scf ( s tan dard cubic fet ) 379.4 ft 3 /(lb mole18)
Masse Volumique
P MWa g RT
Volume Spécifique
Densité (Specific gravity)
V RT 1 m p MWa g
g
g densité du gaz à temperature T et pression P densité de l ' air à temperature T et pression P air
Si l’air et un autre gaz se comportement idéalement, la densité du gaz est
p MWa R T MWa MWa g p MWair MWair 28.96 R T 19
Exercice Considérer un mélange gazeux idéal avec la composition suivante, à 1000 psia et 100 °F. Calculer a) le poids moléculaire apparent, b) la densité, c) la masse volumique, et d) le volume spécifique
Composant
yi
C1
0.75
C2
0.07
C3
0.05
C4
0.04
C5
0.04
C6
0.03
C7 a. 26.14 lbm/lb-mole b. γ = (26.14/28.96) = 0.903 c. ρ = [(1000x26.14)/(10.73x460)] = 4.35 lbm/ft3
0.02 20
Comportement de Gaz Réels Composants Purs Ce qui a été considéré pour les gaz parfaits (volume négligeable des molécules et pas d’attraction ou repulsion entre elles) n’est pas vrai pour les gaz réels, et c’est ce qui les fait dévier de la loi des gaz parfaits. Plusieurs équations d’états (EDE) ont été développées afin de corréler les variables P, V , T avec les mesures expérimentales, et d’exprimer une meilleure relation entre ces variables. P, V , T Un facteur de correction appelé Facteur de Compressibilité ou Facteur Z a été introduit dans l’équation des gaz parfaits
PV ZnRT Compressibility factor
Va actual gas volume Z Vi ideal gas volume
Gaz Parfait : Z 1; Z peut être sup érieur ou égale à 1 pour les gaz réels , dependant de T 21 , P , yi
Z Peut être déterminé expérimentallement : - Measurer volume à T et P - Résoudre l’EDE pour Z
PV ZnRT
Z
Beaucoup de travaux expérimentaux ont conduit à l'établissement d'un rapport entre le facteur de compressibilité et la pression et température (voir figures ci dessous). Donc, actuellement, y a aucun besoin de travail expérimental puisque beaucoup d'information existent sur le changement de Z avec P, et T pour des corrélations basées sur la loi des états correspondants. La loi des états correspondants propose que tous les gaz auront le même comportement quand ils sont analysés en termes de pression réduite, volume réduit, et température réduite, ou autrement dit la déviation par rapport à la loi idéale de n'importe quel gaz réel est proportionnellement la même pour différents gaz quand ils sont dans les mêmes conditions correspondantes (conditions réduites). Propriétés réduites
P Pr PC
Tr
T TC
V Vr VC
22
Méthane
Ethane
Diagramme de facteur de compressibilité 23
Propane
Diagramme de facteur de compressibilité
24
Exercice Calculer le facteur de compressibilité du Méthane, Ethane, et Propane, à pression et température réduites de 2 , et 1.6 respectivement. Solution Utiliser les tables de propriétés physiques pour trouver tout d’abord les propriétés critiques des gaz pour ensuite déterminer les pression et température absolues. Méthane
P Pr . PC (2)(667.8) 1335.6 psia T Tr TC (1.6)(116.63 460) 549.392 R
Ethane
A l’aide de P, T et la figure appropriée
Z 0.88
Propane
P Pr . PC (2)(707.8) 1415.6 psia
P Pr . PC (2)(616.3) 1232.6 psia
T Tr TC (1.6)(90.09 460) 880.166 R
T Tr TC (1.6)(206.01 460) 1065.616 R
Z 0.882
Z 0.886
Noter la similarité des facteurs Z
Efficacité du principe des états correspondants 25
Mélanges de gaz L’application du principe des états correspondants est basée sur l’observation stipulant que la compressibilité est une fonction universelle des pression et températures réduites. Pour les mélanges de gaz, Kay a introduit le concept de pseudo propriétés critiques à la place des propriétés critiques réelles.
Règle de mélange de Kay
y
PPC
i
PC i
TPC
i
yi TC i
i
And the reduced properties are called pseudo reduced properties
PP r
i
P P yi PCi PPC
TP r
T T yi TCi TPC
i
26
Le facteur de compressibilité peut être généralisée avec suffisament d’exactitudes pour la plus part des besoins en intrduisant le concept des pseudo pression et temperatures réduites. Standing et Katz ont presenté en 1942 un facteur de compressibilité généralisé comme montré sur la figure.
- Fiable pour les gaz naturels doux ayant une teneur faible de composants non hydrocarbonés (CNH). - Corrélations les plus largement ises - Bon pour des mélanges de gaz de MW < 40 - Ne peut pas être appliqué pour des gaz ou des vapeurs avec plus de 2% d'H2S et/ou CO2 ou plus de 20 % de N2 (d'autres méthodes sont employées)
Diagramme de Standing et Katz Facteur de compressibilité des gaz naturels
27
Si la composition n’est pas connue : PPC , TPC peuvent être prédits à l’aide
Brown et al. ont d éveloppée une méthode graphique donnant une approximation satisfaisante des pseudo pression et température critiques de gas quand uniquement la densité du gaz est connue
Mathematical correlation Mélanges de gaz naturels
TPC R 168 325 g 12.5 g2 PPC psia 677 15.0 g 37.5 g2 Mélanges de condensats (liquide)
TPC R 187 330 g 71.5 g2
PPC psia 706 51.7 g 11.1 g2 28 Corrélation graphique des pseudo propriétés critiques des gaz naturels
Exercice Déterminer la masse volumique du mélange gazeux suivant. Considérer le mélange parfait at 1000 psia et 100 °F.
Composant
yi
C1
0.75
C2
0.07
C3
0.05
C4
0.04
C5
0.04
C6
0.03
C7
0.02 29
Solution Composant
yi
MWi
y i MWi
TC i R
y i TC i
C1
0.75
16.04
12.030
343.5
257.6
673
504.7
C2
0.07
30.07
2.105
550.1
38.5
708
49.6
C3
0.05
44.10
2.205
666.2
33.3
617
30.9
C4
0.04
58.12
2.325
765.6
30.6
551
22.0
C5
0.04
72.15
2.886
847.0
33.9
485
19.4
C6
0.03
86.18
2.585
914.6
27.4
434
13.0
C7
0.02
100.21
2.004
972.8
19.5
397
7 .9
MWa 26.14 m RT PV ZnRT Z MW a
Ensuite, calculer
PPr
TPC 440.8
V ZRT m P MWa
P 1000 1.54 PPC 647.5
Figure ci dessus : Z = f(propriétés réduites)
Finalement :
PC i psia
et
PPC 647.5
g
TPr
y i PCi
1
P MWa ZRT
T (100 460) 1.27 TPC 440.8
Z 0.725
1000 x 26.14 g 6.00 lb / ft 3 0.725 x 10.73 x 560
30
Exercice Recalculer la masse volumique, de l’exercice précédent, en estimant les pseudo propriétés réduites.
Solution 1. Calculer la densité du mélange gazeux
g
MWa 26.14 0.903 29.96 29.96
2. Déterminer les pseudo propriétés critiques
TPC 168 325 x 0.903 12.5 x 0.9032 451 R
PPC 677 15.0 x 0.903 37.5 x 0.903 2 660 psia 3. Trouver les propriétés pseudo réduites
TPr
560 1.24 451
PPr
1000 1.52 660
4. Déterminer Z à partir de la figure utilisée précédement
Z 0.69
5. Finalement, calculer la masse volumique
g
1000 x 26.14 6.30 lb / ft 3 0.69 x10.73 x 560
31
Effet de composants non hydrocarbonés (CNH) sur Z Les gaz naturels contiennent souvent des CNH notamment: CO2 , N2 , et H2S. Les gaz hydrocarbonéssont classés comme suit: - doux : pas de sulphide d’hydrogène - acides : si [H2S] = 1 grain / 100 ft3
[NHC] ≤ 5% : la précision n’est pas sérieusement affectée [NHC] > 5% : jusqu’à 10 % Z peut être érroné, donc des corrections sont obligatoires.
32
Correction pour CNH Les CNH ont un net effet sur les propriétés des gaz puisque leur facteur de compressibilité a un comportement différent de celui des gaz doux. D’après Wichert et Aziz Ont développé une méthode précise pour le calcul de Z des gaz acides contenant jusqu’à 85% de composants acidiques, et ceci à l’aide de diagrammes standard du facteur de compressibilité des gaz. Ont défini un pseudo facteur d’ajustement de température critique pour ajuster (corriger) les pseudo propriétés critiques du mélange gazeux acide.
f ( CO2 , H 2 S )
' PC
T
TPC
and
PPC'
PPC TPC' TPC B(1 B)
120 ( A0.9 A1.6 ) 15 ( B 0.5 B 4.0 ) [R]
A yH 2 S yCO 2
A : sum of mole fractions of CO2 and H2S in mixture 33 B : mole fraction of H2S
Les étapes de calcul et d’introduction de
dans les calcul du facteur Z
Etape 1: Calculer les pseudo propriétés critiques du mélange de gaz Etape 2: Déterminer le facteur de correction (à partir du diagramme ci dessous ou le calculer à l’aide des équations ci dessus) Etape 3: Corriger PPC et
TPC (calculés à l’étape 1)
Etape 4: Calculer les pseudo propriétés réduites Etape 5: Lire le facteur de compressibilité à partir de la figure de Standing et Katz.
34
Facteur de correction de la pseudo température critique, in °R.
35
Exercice Déterminer la masse volumique d’un mélange gazeux acide, à 1000 psia et 110 °F , ayant la composition ci dessous et considéré idéal.
a. Sans correction due à la présence des CNH b. En utilisant la méthode de correction de Wichert-Aziz c. Que concluez-vous?
Composant
yi
CO2
0.10
H2 S
0.20
N2
0.05
C1
0.63
C2
0.02 36
Solution yi
MWi
yi MWi
PC i psia yi PC i
TC i R
yi TC i
CO2
0.10
44.01
4.401
1071
107.1
547.57
54.757
H2 S
0.20
34.08
6.816
1306
261.2
672 .37
134 .474
N2
0.05
28.01
1.401
493
24.65
227.29
11.365
C1
0.63
16.04
10.105
667
420 .714
343.06
216 .128
C2
0.02
30.07
0.601
707.8
14.156
549.78
11.00
Composant
MWa 23.324
827.82
427.72
Calculer la densité
23.324 g 0.8054 28.96 Ensuite, déterminer à partir de la table ci dessus
PPC 827.82 psia TPC 427.72 R 37
1. La masse volumique sans corrections
PPr
1000 1.208 827.82
TPr
570 1.333 427.72
A l’aide des pseudo propriétés réduites ci-dessus et la figure de Standing-Katz, le facteur Z est Z 0.820
Ensuite, calculer la masse volumique à l’aide de l’équation
g
1000 x 23.324 4.651 lb / ft 3 0.82 x10.73 x 570
1. La masse volumique avec corrections
B yH 2 S 0.2
A yCO2 yH 2 S 0.1 0.20 0.30
Déterminer le facteur de correction
120 ( 0.30 0.9 0.301.6 ) 15 ( 0.20 0.5 0.20 4.0 ) 29.86R ensuite, corriger la pseudo température critique
TPC' 427.72 29.86 397.86 R Après cela, calculer la pseudo pression critique corrigée
PPC'
827.82 x 397.86 727.07 psia 427.72 0.2 x (1 02) x 29.86
38
la pseudo pression reduite est alors égale à
P 1000 1.375 ' PPC 727.07
PPr
Et la pseudo température reduite
TPr
T 570 1.433 TPC' 397.86
finalement, à l’aide des pseudo properties reduites ci-dessus et la figure de Standing-Katz, Le nouveau facteur de compressibilité est
Z 0.837 Et la masse volumique correspondante est
g
1000 x 23.324 4.56 lb / ft 3 0.837 x10.73 x 570
Il y a environ 2 % d’erreur entre les valeurs corrigée et non corrigée. 39
-Carr, Kobayashi, et Burrows ont proposé une procédure simplifiée pour corriger les pseudo propriétés critiques des gaz naturels contenants des CNH. -La méthode est avantageuse lorsque la composition du mélange de gaz est inconnue. -Connaissant la densité du mélange gazeux, déterminer les pseudo température et pression critiques à l’aide de la dernière figure. Ensuite, ajuster, à l’aide des équations suivantes, les pseudo propriétés critiques estimées.
TPC' R TPC 80 yCO2 130 y H 2S 250 y N2 PPC' psia PPC 440 yCO2 600 y H 2S 170 y N2
40
Correction pour les gaz à MW élevé Aucun mélange de MW > 40 n’a été considéré dans la réalisation du diagramme, donc la figure ne peut être applicable aux mélange gazeux de MW > 40 .
Sutton à observé que les déviations sont associés aux mélanges ayant des concentrations élevées d’ heptanes-plus (C7+) , et proposa que les déviations peuvent être minimisées en utilisant les règles de mélange développées par Stuart et al., et des facteurs empiriques de correction liés à la présence de concentration d’heptanes-plus dans le mélange gazeux.
Diagramme de Standing-Katz facteur de compressibilité
41
Approche de correction proposée 1. Calculer les paramètres 0.5 TC 2 TC 1 J yi yi 3 i PC i 3 i PC i
K yi i
2
TC 0.5 PC i
Paramètre de corrélation de Stewart-Burkhardt-Voo
Paramètre de corrélation de Stewart-Burkhardt-Voo
R / psia
R / psia 0.5
2. Déterminer les paramètres de correction
J 0.6081FJ 1.1325 FJ 2 14.004 FJ yC 64.434 FJ yC2 7
7
2
0.5 1 TC 2 TC FJ y y 3 PC C 3 PC C7 7
T
K C0.5 (0.3129 yC 4.8156 yC2 27.3751 yC3 ) PC C 7
7
7
7
Température en [° R] , et Pression en [psia]
3. Corriger les paramètres J and K
K K K '
J ' J J 42
4. Déterminer les pseudo température et pression critiques ajustées
K
' 2
TPC
J
T
'
PPC
TPC ' J
P
5. Utiliser PC et PC calculées et suivre la procédure normale de Standing et Katz pour déterminer le facteur de compressibilité.
43
Analyse Mathématique du Diagramme de Standing-Katz du Facteur de Compressibilité Parfois il est plus pratique d’utiliser des équations mathématiques simples pour des calculs directs du facteur de compressibilité. Méthode de Papay - empirique - 4.8 % erreur
P Z 1 Pr TPr
PPr 0 . 36748758 0 . 04188423 TPr
Il existe d’autres méthodes plus compliquées nécissitant des solutions numériques.
44
La Compressibilité des gaz naturels - Indispensable dans les problèmes de reservoir engineering - Plus importante que celle des liquides - Pour un liquide elle est suffisament faible pour être négligée.
La compressibilité isotherme d’un gaz est le changement de volume par unité de volume par unité de changement de la pression
1 V Cg V P T
n RT Z V P Cg
in
1/ unit pressure
Differentiating
1 V nRT P T P
Z Z 2 P P
1 1 Z P Z P T
Gasz Idéal Z = 1 :
Cg
1 P
45
En termes de pseudo propriétés
Cg
Multiplier l’équation par
1 1 Z PPr PPC Z PPr PPC T Pr
PPC
C g PPC Cr
1 1 Z PPr Z PPr T Pr
Qui est la pseudo compressibilité reduite isotherme et définie comme
Cr C g PPC (Z / PPr )TPr peuvent être calculées à partir de la pente de l’isotherme TPr Les valeurs de du diagramme de Standing-Katz du facteur de compressibilité à la valeur d’intérêt.
46
Exercice Déterminer la compressibilité isotherme d’un mélange gazeux (composition ci dessous) à 1000 psia et 100°F, en considérant a. Un comportement idéal (parfait) b. Un comportement de gaz réel
Composant
yi
C1
0.75
C2
0.07
C3
0.05
n C4
0.04
n C5
0.04
C6
0.03
C7
0.02
47
Solution 1.
Comportement idéal Utiliser dirctement l’équation de Cg
2.
Cg
1 1 10 3 psia 1 P 1000
Gaz réel
a. Calculer
PPC 647.5 psia
b. Ensuite
PPr
1000 1.54 647.5
TPC 440.8 R TPr
(100 460) 1.27 440.8
c. A l’aide de la figure de Standing-Katz on obtient Z 0.725
et la pente
Z 0.17 P Pr TPr 1.27 d. Déterminer la pseudo compressibilité reduite isotherme
Cr
1 1 ( 0.17) 0.8808 1.54 0.725
e. Finallement, calculater la compressibilité du gaz
Cg
Cr 0.8808 1.361 x10 3 psia 1 PPC 647.5
48
L’exemple peut être résolu à l’aide du diagramme de Trube
Cr 0.90 Cg
Cr 0.90 1.390 x10 3 psia 1 PPC 647.5
Il existe d’autres méthode plus compliquée telle que la méthode de Mattar-Brar-Aziz (n’est pas donnée ici)
Pseudo compressibilité reduite des gaz naturels Diagramme de Trube
49
Facteur Acentrique Un troisième paramètre , le facteur acentrique développé par K. S. Pitzer en 1955, comme paramètre de corrélation pour caractériser la non sphéricité d'une molécule. Il a été largement accepté et considéré afin de surmonter certaine limites du principe des états correspondant. Définition du facteur acentrique
log 10 Prsat T
r
Prsat
Dépendence approximative de T = f(pression de vapeur)
Facteur acentrique moyen d’un mélange
0.7
1
Pv PC
est zéro pour l’argon, krypton, et xenon
D’après la théorie de Pitzer (états correspondants basés sur les 3 paramètres) tous les fluides ayant la même valeur ont la même valeur du facteur Z une fois comparés aux mêmes Pr et Tr .
m yi i 50
Pression de vapeur
(sera discutée en détails)
La pression de vapeur d’une substance est la pression exercée par sa phase vapeur en equilibre avec sa phase liquide ou solide à une température donnée.
Po int Critique C
P Pr ession P
Liquide
Liquide
Gas
Vapeur
T1
A
B
T2
T Correlation
Volume
T T ln PV 19 1 b 8.5 ln b T T
51
52
Pression de vapeur à basse température d’hydrocarbures légers
Pr ession de Vapeur [ psia ]
Temperature 53 F Pression de vapeur de composants d’hydrcarbures
Viscosité Résistance à l’écouement, égale au rapport de la contrainte de cisaillemnt (force tangentielle/unité de surface) sur le taux de cisaillement (gradient de vitesse local):
Fonction de la forme
g g ( P, T , yi )
Procédure de calcul Carr, Kobayashi, et Burrows ont développé des corrélations graphiques pour estimer la viscosité des gazs naturels en fonction de la pression, temperature et densité du gaz.
1. Chercher PPC et MWa , et corriger les si [NHC] > 5 moles pour cent 2. Utiliser la figure ci dessous pour déterminer la viscosité du gaz naturel à 1 atm et temperature d’intérêt. Cette viscosité, nommée 1 , doit être corrigée à cause de la présence des CNH (à l’aide des médaillons des figures). Les fractions des CNH tendent à augmenter la viscosité de la phase gazeuze, mathématiquement
1 1 u CO H S N 2
3. Déterminer les pseudo pression et temperature reduites
2
2
54
4. Déterminer
g
/ 1
à l’aide des pseudo propriétés reduites
g = viscosité du gaz aux conditions désirées.
Corrélation de rapport de viscosité de Carr 5. Finalement, calculater g à l’aide de
g
g 1 1
55
Corrélation de viscosité atmosphérique du gaz de Carr 56
. . .
G: specific gravity
Correction de viscosité due à la présence de H2S
57
Correction de viscosité due à la présence de CO2
58
Correction de viscosité due à la présence de N2
59
60
Viscosité de gaz en fonction de différentes variables
61
Viscosité de gaz en fonction de différentes variables
Herning et Zipperer ont proposé l’équation ci dessous pour estimer la viscosité de mélanges gazeux n
m
i 1 n
yi MWi
i
y i 1
i
MWi
62
Exercice Déterminer la viscosité du mélange gazeux à 3500 psia et 200 °F.
Composant
yi
N2
0.05
CO2
0.05
H2S
0.02
C1
0.80
C2
0.05
C3
0.03
63
Solution Dans ce cas il y a une correction à effectuer due à la présence des CNH.
1. Calculer :
MWa
g
MWa
y MW i
PPC i
TPC
19.97
i
g
g density of gas at temperature T and pressure P 19.97 0.689 density of air at temperature T and pressure P air 28.96
TPC 168 325 g 12.5 g2 380.43 R
PPC 677 15.0 g 37.5 g2 665.11 psia 2. Corriger les pseudo propriétés critiques calculer en 1. (à cause de la présence des CNH)
TPC' TPC 80 yCO2 130 y H 2S 250 y N2
TPC' 380.43 80 x 0.05 130 x 0.02 250 x 0.05 366.53 R
PPC' PPC 440 yCO2 600 yH 2 S 170 yN 2 PPC' 665.11 440 x 0.05 600 x 0.02 170 x 0.05 690.61 64 psia
3. A l’aide de la dernière figure de Carr, estimer la viscosité non corrigée à 1 atm et 200 °R
1 u
0.0123
4. Utiliser les figures médaillons (Carr) pour estimer
N
2
0.00042
CO
2
0.00026
H S 0.00005 2
5. Déterminer la viscosité corrigée du gaz à pression atmospherique température du système
1 0.0123 0.00042 0.00025 0.00005 0.01303 6. Déterminer
TPr
660 1.80 366.53
PPr
3500 5.07 690.61
7. A l’aide de la correlation graphique du rapport des viscosités de Carr estimer
g 1.52 1 Finalement, déterminer la viscosité du mélange gazeux
g 1
g
1 1.52 x 0.01303 0.01981
65
Exercice Calculer la viscosité d’un gaz naturel de densité 0.702 à 195 ° F et 1815 psia
66
Solution 1. Estimer les propriétés pseudo critiques à l’aide de la densité g 2. Chercher les propriétés réduites PR = (1815 / 669) = 2.72
;
TR = (195 + 460) / 390 = 1.68
3. Lire à partir des figures ci-dessus
g 1.28 1 1 0.012 Finalement
g g 1
1 1.28 x 0.012 0.0154 67
Exercice Déterminer le facteur de compressibilité du mélange gazeux acide ci dessous, à 2000 psia et 150 °F.
a. Sans correction due aux CNH b. Avec correction due aux CNH Que concluez vous? Expliquer.
Composant N2 CO2 H2S Méthane Ethane Pr opane i bu tan e n bu tan e i pen tan e n pen tan e n hexane n hep tan e n oc tan e n nonane n décane
fraction molaire 0.0345 0.0130 0.0000 0.8470 0.0586 0.0220 0.0035 0.0058 0.0027 0.0025 0.0028 0.0028 0.0015 0.0018 0.0015 68
Solution Sans correction MWa 19.91 ; m
19.91 0.686 29
PPC 663.3 psia
TPC 374.1 R
PPr
2000 3.02 663.3
TTr
(150 460) 610 1.63 374.1 374.1
Z 0.83 Avec correction Trouver le factor d ' ajustement de la T 120( A 0.9 A1.6 ) 15( B 0.5 B 4.0 )
120 0.0130 0.0000
0. 9
0.0130 0.0000 1. 6 0 2.29 R
TPC' TPC 374.1 2.29 371.81 R PPC'
PPC TPC' 663.3 x 371.81 659.24 psia TPC B(1 B) 374.1 0
PPr
2000 3.03 659.24
Donc , Z 0.84
TPr
150 460 1.64 371.81
69
Standing a proposé une autre méthode mathématique pour estimer la viscosité à pression atmosphérique et température du système :
1 1 u CO H S N 2
1 u
2
2
[1.709 x105 2.062 x106 g ] ( T 460 ) 8.188 x103 6.15 x103 log g
T = température du système en °R
1 u
N
2
CO
y N 2 8.48 x10 3 log ( g ) 9.59 x10 3
8.49 x10
3 3 y 9 . 08 x 10 log ( ) 6 . 24 x 10 CO2 g 2
H S y H S 2
2
3
log ( g ) 3.73 x10 3
Lee, Gonzalez, et Eakin ont proposé une expression semi empirique en termes de température du système et Mwa pour estimer la viscosité du gaz
g Y g 10 K exp X 62 . 4 4
g : en lb / ft à P et T du système 3
T : température du système MWa : MW apparent du mélange gazeux
X 3.5 K
,
986 0.01 MWa T
9.4 0.02 MWa T 1. 5 209 19 MWa T
Y 2.4 0.2 X
70
Dean et Stiel ont proposé une autre méthode mathématique pour estimer la viscosité du gaz naturel à pression atmosphérique et température du réservoir. 8/9 T 1 34 x 10 5 Pr
for TPr 1.5
m
1 m
166.8 x10 5 ( 0.1338 TPr 0.0932) 5 / 9
m
for TPr 1.5
Est une paramètre de viscosité défini comme suit:
1/ 6 TPC m 5.4402 2/3 MWa0. 5 PPC
Ils ont aussi préconisé
g 1 r
10.8 x10 5 exp 1.439 r exp 1.111 r1.888
0.27 PPr Z TPr
m
g : en à P et T du système 1 : en à 1 atm et T du système 71 r : masse volumique réduite du gaz
Viscosité de différents gaz à 1 atm
72
Densité
D e n s i t é
D e n s i t é
Viscosité de gaz d’hydrocarbures
73
Conductivité Thermique dT q k dx
Flux de chaleur du à la conduction
[ BTU / hr ft 2 ]
La conductivité thermique, pour des mélanges de gaz naturels à pression élevée, peut être estimée à partir d'une valeur atmosphérique et d'une correction de pression.
Example Déterminer la conductivité thermique d’un gaz naturel de MW = 25 à 700 psia et 300 °F.
Solution 1. Chercher les propriétés critiques
TC 440 R
PC 660 psia
2. Calculer les propriétés réduites
Tr
(300 460) 1.73 440
700 Pr 1.06 660 74
3. A l’aide de la figure ci-dessous déterminer la conductivité thermique kA à 1 atm
Conductivité thermique de gaz naturels et d'hydrocarbures at 1atm
k A 0.0248 Btu /[( hr . ft 2 .F ) / ft] or 0.0248 Btu . hr 1. ft 1.F 1
75
4. Déterminer le rapport
k 1.15 kA 5. Finalement, déterminer la k du gaz
k k k A 1.15 x 0.0248 0.0285 Btu hr 1 ft 1 F 1 kA
MELANGES Méthode de Stiel et Thodos : Lire, à partir des diagrammes, k de chaque composant à la T désirée. km est estimée à l’aide de la Règle Racine Cubique applicable aux mélanges se composant de gaz simples et pas de CO2.
km
yk y i
i
i 3
3
MWi
MWi
Rapport de conductivité thermiques de gaz 76
Rapport de conductivité thermique
k kA
77
Exercice 12.1 A l’aide de la méthode Stiel-Thodos, chercher la conductivité thermique du mélange gazeux à 200 °F et 1 atm.
Composant
yi
N2
0.05
CH 4
0.80
C2 H 6
0.15
78
Propriétés Thermodynamiques - Enthalpie • gaz parfaits • gaz réels
- Entropie - Chaleur spécifique
79
Correlation Enthalpique Définition
H U PV
dH dU d (PV ) Forme différentielle U, P, et V sont des fonctions d’états
H U (PV ) H : fonction d’état
-Apparait fréquement dans les écoulements -Le changement de l’enthalpie avec T et P est complexe -La procédure de prédiction de ΔH de substances pures ou de mélanges est basée uniquement sur des données expérimentales, donc, les diagrammes P- H sont très recommandés et utilisés.
80
Effet de pression sur l’enthalpie d’écoulement de gaz naturels
Gaz Réels L’enthalpie de mélanges de gaz réels et des liquides peut être estimée à l’aide de calculs manuels. Ceux recommandés pour l'usage sont basés sur une extension du principe des états correspondants et sont donnés dans les figures ci-dessous.
La correlation applicable aux mélanges gazeux et liquides se compose de deux parties: Changement d’enthalpie avec la pression pour un fluide simple (fluide avec facteur acentrique zéro),
Correction pour la déviation d'un fluide réel par rapport au changement enthalpique avec la pression d'un fluide idéal.
Effet de pression sur l’enthalpie (fluide Simple)
81
Effet de pression sur l’enthalpie (Correction pour fluides réels)
Enthalpies d’états idéaux (parfaits) Les enthalpies de beaucoup de substances gazeuzes pures sont aisément corrélées en série de puissance de la température. Les figures ci-dessous montrent des valeurs typiques d’enthalpie de composants de gaz naturel.
82
Enthalpie idéale (correspondant à l’état idéal) de composants purs
Mélanges La référence d’enthalpie choisie est l’enthalpie zéro à pression et température absolues nulles, c’est la même référence utilisée dans API Project 44.1. Le choix de la référence est arbitraire et représente un moyen de convenance. La valeur absolue de l’enthalpie ne présente pas d’intérêt ; seules, ses variations entre deux états sont recherchées, puisqu’elles fournissent la quantité de chaleur à fournir ou à extraire. Les différences d’enthalpie qui sont les valeurs d’intérêt, ne sont pas altérées par le choix de la référence. Cependant, la même enthalpie de référence doit être utilisée pour tous les composants dans tous les calculs. La variation d'enthalpie de mélanges de gaz réels est calculé à l'aide d'une corrélation préparée à partir de mesures expérimentales d'enthalpie d'une variété de mélanges.
H TP H 00 H T0 H 00 H T0 H TP
H TP
BTU / lb mole
: l’enthalpie à pression et température d’intérêt
H
0 T
H 00
: l’enthalpie idéale au dessus de la référence H
H
0 T
H TP
de l’enthalpie avec la pression, donné par la différence d’enthalpie entre l’enthalpie idéale :etChangement l’enthalpie à la pression désirée; les deux quantitée sont à la température.
0
, à la température d’intérêt
H 00 0 à la référence choisie, température absolute zéro ou
HH H H 0
0
H : enthalpie à T d ' int érêt 0
H : enthalpie idéale
HTP HT0 HT0 HTP 83
Méthode de Calcul
H
0
H
calculée à partir de
0 (') 0 0 H H H H 0 H H R TC R T R T C C
H
0
H / R TC
H
0
H / R TC
0
( ')
Variation d’enthalpie avec la pression d’un fluide simple (donné par fig. cidessus) Correction due à la déviation d'un fluide réel par rapport à la variation de l'enthalpie idéale avec la pression, donnée par les figures ci-dessus.
Pour pouvoir utiliser les figures de gaz réels ci-dessus : - La composition du mélange doit être connue - Les pseudo T et P critiques du mélange sont calculées à l’aide de la règle de Kay - L’enthalpie moyenne du mélange
H m0 yi Hi0 H i0 enthalpie idéale de composant pur i x MWi 84
Enthalpie de formation de différents gaz
85
Exemple Calculer l’enthalpie du mélange gazeux à 1010 psia et 120 °F.
Composant
yi
Méthane CO2
0.9010 0.0106
Ethane
0.0449
Pr opane i Bu tan e
0.0187 0.0065
n Bu tan e i Pen tan e
0.0045 0.0017
n Pen tan e Hexane
0.0019 0.0052
86
Solution. yi
MWi
TC R
PC psia
i
Méthane CO2
0.9010 0.0106
16.04 44.01
343.0 547.5
667.8 1071.0
0.0108 0.2667
292 100
Ethane
0.0449
30.07
549.8
707.8
0.0972
189
Pr opane i Bu tan e n Bu tan e
0.0187 0.0065 0.0045
44.10 58.12 58.12
665.7 734.6 765.3
616.3 529.1 550.7
0.1515 0.1852 0.1981
162 151 162
i Pen tan e n Pen tan e
0.0017 0.0019
72.15 72.15
828.7 845.3
490.4 488.6
0.2286 0.2510
151 158
Hexane
0.0052
86.18
912.0
470.0
0.2990
139
Composant
H i0 BTU / lb
m 0.0243
H 0 4857.31 BTU / lb mole
H i0 enthalpie idéale du composant i ( figure : ideal enthalpy of pure components)
87
1. Déterminer les pseudo température et pression critiques du mélange
PPC 666.47 psia
TPC 367.96 R
Présence de CNH (CO2 ), donc correction des pseudo paramètres critiques (c< 5% donc on peut ignorer la correction)
120 (0.01060.9 0.01061.6 ) 1.92
TPC' 367.96 1.92 366.04 R PPC'
666.47 x 366.04 662.99 psia 367.96
2. Déterminer les paramètres réduits
PPr
1010 1.52 662.99
TPr
(120 460) 1.59 366.04 88
3. Calculer
0
H0 H 0.68 R T C
H0 H R T C
( ')
0.015
et
0.0243
0 ( ') 0 0 H H H H 0 H H m R TC R T R T C C 1.987 x 366.04 x 0.68 (0.0243 x 0.015) 494.87 BTU / lb mole
4. Finalement, l’enthalpie du mélange est égale à l’enthalpie idéale moins l’enthalpie correspondant à la déviation par rapport à l’état idéal
H 0 H m 494.87 BTU / lb mole H m H 0 494.87 H m 4857.31 494.87 4362.44 BTU / lb mole 89
Correlation d’Entropie - Dépend des états initial et final, donc fonction d’état. - D’un point de vue microscopique: une augmentation d’entropie est associée à une augmentation de désordre (ou réduction d ‘ordre) au niveau moléculaire. - L'entropie est plus employée comme guide pour interpréter le comportement des gaz et des liquides dans les procédés de compression et d'expansion - Le changement de l'entropie de n'importe quel système subissant un processus réversible est égal à
dS
dQR T
or
S
dQR T
dQ : var iation d ' energie int erne L’entropie d’un mélange à multicomposants peut être évaluée en combinant l’entropie idéale (correspondant à l’état idéal) de API 44 avec les valeurs de variation de l’entropie avec la pression données par les tables de Curl et Pitzer. Il n’existe pas d’équations d’entropie pour les mélanges indéfinis (pseudo composants) mais, pour la plus part des cas où les pseudo composants sont présents en petite concentration, ils peuvent être approximés d'une manière satisfaisante par la paraffine hydrocarbonnée ayant le poids moléculaire le plus proche. 90
Méthode de calcul Similaire à celle de la correlation d’enthalpie 1. Calculer l’entropie idéale pour une phase fluide (gaz ou liquide) à une température donnée
Sm0 yi Si 0 R yi ln yi
S i 0 : entropie idéale de i donnée par la figure
91
Entropie idéale de composants purs
2. L’effet de la pression (pour une T donnée) est calculée à l’aide dela correlation de Pitzer:
S
0
S
m
S 0 S 0 R R
S0 S R
( ')
Ln P [atm]
S 0 S R
0
S 0 S R
( ')
92
Effet de pression sur l’entropie pour un fluide simple
Effet de pression sur l’entropie (Correction pour fluide réel)
Example Calculer l’entropie du mélange gazeux 1010 psia et 120 °F, (exemple précédent) yi
MWi
TC R
PC psia
i
Methane CO2
0.9010 0.0106
16.04 44.01
343.0 547.5
667.8 1071.0
0.0108 0.2667
3.150 1.176
Ethane
0.0449
30.07
549.8
707.8
0.0972
2.036
Pr opana i Bu tan e n Bu tan e
0.0187 0.0065 0.0045
44.10 58.12 58.12
665.7 734.6 765.3
616.3 529.1 550.7
0.1515 0.1852 0.1981
1.624 1.400 1.338
i Pen tan e n Pen tan e
0.0017 0.0019
72.15 72.15
828.7 845.3
490.4 488.6
0.2286 0.2510
1.260 1.245
Hexane
0.0052
86.18
912.0
470.0
0.2990
1.198
Component
m 0.0243
S i 0 BTU / lb R
S 0 51.9016 BTU / lb mole R
S i0 Entropie idéale de i ( figure ideal entropy of pure components) 93
1. Determiner les pseudo temperature et pression critiques du mélange
PPC 666.47 psia
TPC 367.96 R
Presence de NHCs (CO2 ), donc correction (c< 5% donc on peut ignorer la correction)
120 (0.0106 0.9 0.01061.6 ) 1.92R
TPC' 367.96 1.92 366.04 R PPC'
666.47 x 366.04 662.99 psia 367.96
2. Déterminer les paramètres réduits
PPr
1010 1.52 662.99
TPr
(120 460) 1.59 366.04 94
3. A l’aide des deux dernières figures
S0 S R
0
S0 S 0.345 R
( ')
0.065
4. Facteur acentrique apparent du mélange
0.0243 5. Déterminer la différence d’entropie entre les états idéal et reel
S
0
S
m
( ') S 0 S 0 S 0 S Ln P R R R 1010 1.987 0.345 0.0243 0.065 ln 14.7 9.093 BTU / lb mole R
6. Trouver l’entropie idéale pour le mélange
Sm0 yi Si 0 R yi ln yi
(Note the Napierian logarithm)
S m0 51.9016 ( 0.920) 52.8216 BTU / lb mole R 7. Finalement, l’entropie du mélange est égale à l’entropie idéale moins l’entropie correspondant à la déviation de l’état idéal , ou bien utiliser l’équation
S m at P , T S m0 S 0 S
m
S m 52.8216 9.093
43.7286 BTU / lb mole R
95
Chaleur Spécifique Quantité de chaleur nécessaire pour augmenter la température de un degré d’une masse donnée d’un matériau.
dQ n C dT
or
Chaleur spécifique molaire
dQ m C dT Chaleur spécifique massique, Chaleur Spécifique
Définie pour seulement deux chemins différents : pression constante et volume constant :
mesurée à pression constante
CV
mesurée à volume constant
96
- Substance Homogène : Chaleur spécifique = f ( P,T ) -Chaleurs spécifiques idéales sont de bonnes approximations pour les chaleurs -spécifiques de gaz réels à faibles pressions. -Chaleurs spécifiques idéales sont fonction de la température seulement -(indépendentes de la pression)
' T T 2
(A) ( ' ) : idéal
' a b T c T
C C R ' P
' V
2
(B)
Connaissant la dépendence de la température de l’une on trouvera celle de l’autre
97
Relation - CV
dH dU R dT dU CV dT at cst V C P CV R dH C p dT at cst P
98
Equation (A)
BTU /lb mole F
or
cal /g mole C
Constants for the molar heat capacity equation of organic gases in the ideal gas state
99
Equation (B)
BTU /lb mole F
or
cal /g mole C
Constants for the molar heat capacity equationof inorganic gases in the ideal gas state
100
Frequently asked to evaluate T
' ' C dT C P mean T T0 P T0
T
' C P dT
C P' mean
T0
T
T0
The base temperature is taken at a constant value such as 25°C and mean is determined as a function of the upper limit of integration .
' mean
is on next figures
e.g. : for CO2 : 12.1 BTU/lb-mole °F read at 2000 °F is the mean value between 77 and 2000 °F.
Gas Mixtures
C P' , m
i
yi C P' , i 101
Mean molar heat capacities of gases in the ideal gas state
Base temperature = 77 °F
102
Mean molar heat capacities of gases in the ideal gas state
Base temperature = 77 °F
103
104
Specific heat of hydrocarbon gases
Specific heat of hydrocarbon liquids
105
Exercise 15.1 Write the methane equation given below in of the following temperature units: a. °C, b. °R, c. °F. The molar heat capacity of methane in the zero-pressure state is given by the equation
' 3.381 18.044 x10 3 T 4.300 x10 6 T 2 Hint : T ( K ) = T( °R ) / 1.8 T ( K ) = [T( °F ) + 460] / 1.8 T ( K ) = T ( °C ) + 273
Answer a. C P' 7.99 15.70 x 10 3 T 4.300 x 10 6 T 2 b . C P' 3.381 10.03 x 10 3 T 1.327 x 10 6 T 2 c . C P' 7.79 8.81 x 10 3 T 1.327 x 10 6 T 2
106
Mid Term Exam Ex. 01 a. Expliquer brièvement et clairement ce qu’un point critique d’un gaz. b. When can it be said that two systems are in corresponding states. Explain using an example. c. Expliquer brièvement l’importance du facteur acentrique par rapport au principe des états correspondants..
Ex.02 Calculate the density of the following gas mixture at 1000 psia and 120 °F
Component
yi
CO2
0.10
H2S
0.15
C1
0.63
C2
0.02
C3
0.05
C4
0.05
Ex.03 Use the equations given below to calculate the heat required in to raise the temperature of ethane from 500 to 1000 °F in a flow process at a pressure of approximately 1 atm.
Q H
T2
' C P dT T1
107
Mid Term Exam Correction Ex.01 Component CO2 H 2S C1 C2 C3 n C4
yi
MWi
yi MWi
TCi R
yi TC i
PC i psia
yi PC i
0.10 0.15
44.01 34.08
4.401 5.112
547.91 672.45
54.791 100.868
1071 1300
107.100 195.000
0.63 16.043 0.02 30.07
10.107 0.601
343.33 549.92
216.298 10.998
666.4 706.5
419.832 14.130
0.05 44.097 0.05 58.123
2.205 666.06 33.303 2.906 765.62 38.281 MWa 25.336 TPC 454.539 R
616.0 550.6 PPC
30.800 27.530 794.392 psia
B yH 2 S 0.15 A yH 2 S yCO2 0.15 0.1 0.25 1. Adjustment factor
120 ( A0.9 A1.6 ) 15 ( B 0.5 B 4.0 ) 120 ( 0.250.9 0.251.6 ) 15 ( 0.150.5 0.15 4.0 ) 27.205 R 2. Corrected pseudo critical properties TPC' 454.539 27.205 427.334 R ' PC
P
TPC
PPC TPC' 794.392 x 427.334 741.190 psia B (1 B ) 454.539 0.15 (1 0.15 ) x 27.205
108
3. Reduced properties
PPr
(120 460) 1000 1.349 ; TPr 1.357 741.190 427.334
4. Find compressibility factor fro Standing-Katz chart
Z 0.81 5. Finally calculate the density
g
P MWa 1000 x 25.336 5.026 lb / ft 3 Z RT 0.81 x10.73 x (120 460)
with
psia . ft 3 R 10.73 lb mole.R
109
Ex.02
ETHANE C P' 2.247 38.201 x10 3 T 11.049 x10 6 T 2
T K
The required heat to raise temperature from T1 to T2
Q H
T2
' C P dT T1
Q H
T2
(2.247 38.201 x 10 3 T 11.049 x 10 6 T 2 ) dT
T1
811
2 3 3 T 6 T Q H 2.247 T 38.201 x 10 11.049 x 10 2 3 533
Q H 6354.35 cal / g mole 110
1
M. BELLAHCENE UFR: Gas, Refining & Petrochemistry
2
Séances Régulières
-Lundi : -Mardi :
13:30 - 16:30 13:30 - 16:30
Lieu : Amphi 5ème Etage
3
Contrôle 02 Examens:
01 mid term 40% 01 examen de synthèse 60%
4
Estimation Des Propriétés Physiques Des Hydrocarbures
5
Références T. H. Ahmed, ‘Hydrocarbon Phase Behavior’ , Contribution in Petroleum Geology & Engineering Vol. 7, Gulf Publishing Company, Huston, 1989.
T. H. Ahmed, ‘Hydrocarbon Phase Behavior’ , Contribution in Petroleum Geology & Engineering Vol. 5, Gulf Publishing Company, Huston, 1989. R. C. Reid, ‘The Properties of Gases and Liquids’ , Third Edition, McGraw Hill, New York, 1977.
J. M. Smith, ‘Introduction to Chemical Engineering Thermodynamics’ , Third Edition, McGraw Hill, New York, 1975. D. L. Katz et al., ‘Handbook of Natural Gas Engineering’ , McGraw Hill, New York, 1959. R. W. Gallant, C. L. Yaws, ‘Physical Properties of Hydrocarbons’ , V.1, Second Edition, Gulf Publishing Company, 1992. Gas Processors Suppliers Association, ‘Engineering Data Book’ , GPSA, 1974. C. U. Ikoku, ‘Natural Gas Engineering’ , PennWell Books, 1980 6
Introduction - Thermodynamique : systèmes fermés / ouverts. - Evolution des Propriétés : due à l’échange avec l’environnement.
- Description d’Etat : en déterminant ses propriétés (T, P, V, yi) - Compilation de données expérimentales de plusieurs espèces -Valeurs de propriétés indisponibles : Théorie, méthode d’estimation ou combination des deux - Equations Empiriques - Parfois inclure l’empiricisme dans des équations existantes telles
a PV nRT P 2 V b RT V
7
Types de Méthodes d’Estimations Une méthode d’estimation Idéal
1 – Donner des résultats physiques et thermodynamiques acceptables pour substances pures et mélanges pour toutes conditions 2 – Indiquer l’état 3 – Requiert peu d’information d’entrée 4 – Précise 5 – Temps de calcul court Methodes d’estimation : pas idéales mais donnent des résulats acceptables. Utiliser méthodes simples lorsque les valeurs approximatives sont acceptées. Preférence de données expérimentales.
8
Loi des Etats Correspondants D’aprés van der Waals
- Les propriétés dépendant des forces intermoléculaires sont liées aux propriétés critiques de la même manière pour tous les composés (Not perfect) - Deux substances sont dites dans des états correspondants quand leurs propriétées réduites sont les mêmes.s mêmes. - La déviation d’un gaz réel par rapport à la loi des gaz parfaits est la même pour différents gaz aux mêmes conditions correspondants de P et T . r
r
- C’est une base importante pour le développement de correlations et méthodes d’estimation. - Plus correcte/précise pour les substances physicochimiquement similaires. 9
AC : Liquide saturé BC : Vapeur saturée
Critical Po int C
Pr essure Liquid
Liquid
Gas
Vapour
T1
A B
T2
Volume Comportement volumétrique d’une substance pure tel que prédit par l’Equation d’Etat (EE) de van der Waals
10
La loi des états correspondants telle qu’appliquée aux propriétés du méthane et l’azote. Valeurs experimentales : ○ Méthane, ● Azote.
11
Courbes d’Equilibre Liquide-Vapeur
12
Propriétés Physiques de Substances Pures
13
Constante des Gaz Parfaits R 8.314 J / ( g mole) K 1.987 cal /( g mole) K
83.14 cm 3 . bar / ( g mole) K 82.05 (cm 3 . atm) /( g mole) K 0.7302 (atm . ft 3 ) /(lb mole) R 10.73 ( psia . ft 3 ) / lb mole) R 1545 ( ft . lb f ) / (lb mole) R 1.987 Btu / (lb mole) R
14
Comportement de Gaz Parfaits Volume des molécules négligeable devant le volume du milieu où elles sont confinées, et pas de forces d’attraction ou de répulsion entre elles.
1. Gaz Purs Loi des gaz parfaits
ou
PV n R T
m PV RT MW
m P MW g V RT 15
2. Mélanges de gaz parfaits
Pm Vm R Tm
Décrits par la loi des gaz parfaits
(m mélange)
Le comportement des mélanges est plus intéressant que celui des corps purs puisque en pratique les gaz existent et/ou sont utilisés le plus souvent sous forme de mélanges de composants d’ydrocarbures.
- fraction molaire
yi
ni n
ni
n
i
i
- fraction massique
wi
mi m
wi
mi
m
ou i
i
- fraction volumique
Vi v V
yi MWi yi MWi i
yi
wi / MWi
(w / MW ) i
i
i
Vi Vi i
16
Exercice 1 Déterminer la composition en fraction massique
Composant
Fraction Molaire y i
C1
0.65
C2
0.10
C3
0.10
C4
0.10
C5
0.05
Exercice 2 Déterminer la composition en fraction molaire
Composant
Fraction Massique wi
C1
0.40
C2
0.10
C3
0.20
C4
0.20
C5
0.10
17
Propriétés de Mélanges Gazeux Parfaits Poids moléculaire Apparent
MWa yi MWi i 1
Volume Standard
(1) R Tsc Vsc Psc
1 mole PSC 14.7 psia (1 atm) TSC 60 F
(15.6 C )
R 10.73 psia . ft 3 . (lb mole) 1 . R 1
1 x 10.73 psia. ft 3 .(lb mole) 1 .R 1 x (60 460) R Vsc 14.7 psia VSC 379.4 scf ( s tan dard cubic fet ) 379.4 ft 3 /(lb mole18)
Masse Volumique
P MWa g RT
Volume Spécifique
Densité (Specific gravity)
V RT 1 m p MWa g
g
g densité du gaz à temperature T et pression P densité de l ' air à temperature T et pression P air
Si l’air et un autre gaz se comportement idéalement, la densité du gaz est
p MWa R T MWa MWa g p MWair MWair 28.96 R T 19
Exercice Considérer un mélange gazeux idéal avec la composition suivante, à 1000 psia et 100 °F. Calculer a) le poids moléculaire apparent, b) la densité, c) la masse volumique, et d) le volume spécifique
Composant
yi
C1
0.75
C2
0.07
C3
0.05
C4
0.04
C5
0.04
C6
0.03
C7 a. 26.14 lbm/lb-mole b. γ = (26.14/28.96) = 0.903 c. ρ = [(1000x26.14)/(10.73x460)] = 4.35 lbm/ft3
0.02 20
Comportement de Gaz Réels Composants Purs Ce qui a été considéré pour les gaz parfaits (volume négligeable des molécules et pas d’attraction ou repulsion entre elles) n’est pas vrai pour les gaz réels, et c’est ce qui les fait dévier de la loi des gaz parfaits. Plusieurs équations d’états (EDE) ont été développées afin de corréler les variables P, V , T avec les mesures expérimentales, et d’exprimer une meilleure relation entre ces variables. P, V , T Un facteur de correction appelé Facteur de Compressibilité ou Facteur Z a été introduit dans l’équation des gaz parfaits
PV ZnRT Compressibility factor
Va actual gas volume Z Vi ideal gas volume
Gaz Parfait : Z 1; Z peut être sup érieur ou égale à 1 pour les gaz réels , dependant de T 21 , P , yi
Z Peut être déterminé expérimentallement : - Measurer volume à T et P - Résoudre l’EDE pour Z
PV ZnRT
Z
Beaucoup de travaux expérimentaux ont conduit à l'établissement d'un rapport entre le facteur de compressibilité et la pression et température (voir figures ci dessous). Donc, actuellement, y a aucun besoin de travail expérimental puisque beaucoup d'information existent sur le changement de Z avec P, et T pour des corrélations basées sur la loi des états correspondants. La loi des états correspondants propose que tous les gaz auront le même comportement quand ils sont analysés en termes de pression réduite, volume réduit, et température réduite, ou autrement dit la déviation par rapport à la loi idéale de n'importe quel gaz réel est proportionnellement la même pour différents gaz quand ils sont dans les mêmes conditions correspondantes (conditions réduites). Propriétés réduites
P Pr PC
Tr
T TC
V Vr VC
22
Méthane
Ethane
Diagramme de facteur de compressibilité 23
Propane
Diagramme de facteur de compressibilité
24
Exercice Calculer le facteur de compressibilité du Méthane, Ethane, et Propane, à pression et température réduites de 2 , et 1.6 respectivement. Solution Utiliser les tables de propriétés physiques pour trouver tout d’abord les propriétés critiques des gaz pour ensuite déterminer les pression et température absolues. Méthane
P Pr . PC (2)(667.8) 1335.6 psia T Tr TC (1.6)(116.63 460) 549.392 R
Ethane
A l’aide de P, T et la figure appropriée
Z 0.88
Propane
P Pr . PC (2)(707.8) 1415.6 psia
P Pr . PC (2)(616.3) 1232.6 psia
T Tr TC (1.6)(90.09 460) 880.166 R
T Tr TC (1.6)(206.01 460) 1065.616 R
Z 0.882
Z 0.886
Noter la similarité des facteurs Z
Efficacité du principe des états correspondants 25
Mélanges de gaz L’application du principe des états correspondants est basée sur l’observation stipulant que la compressibilité est une fonction universelle des pression et températures réduites. Pour les mélanges de gaz, Kay a introduit le concept de pseudo propriétés critiques à la place des propriétés critiques réelles.
Règle de mélange de Kay
y
PPC
i
PC i
TPC
i
yi TC i
i
And the reduced properties are called pseudo reduced properties
PP r
i
P P yi PCi PPC
TP r
T T yi TCi TPC
i
26
Le facteur de compressibilité peut être généralisée avec suffisament d’exactitudes pour la plus part des besoins en intrduisant le concept des pseudo pression et temperatures réduites. Standing et Katz ont presenté en 1942 un facteur de compressibilité généralisé comme montré sur la figure.
- Fiable pour les gaz naturels doux ayant une teneur faible de composants non hydrocarbonés (CNH). - Corrélations les plus largement ises - Bon pour des mélanges de gaz de MW < 40 - Ne peut pas être appliqué pour des gaz ou des vapeurs avec plus de 2% d'H2S et/ou CO2 ou plus de 20 % de N2 (d'autres méthodes sont employées)
Diagramme de Standing et Katz Facteur de compressibilité des gaz naturels
27
Si la composition n’est pas connue : PPC , TPC peuvent être prédits à l’aide
Brown et al. ont d éveloppée une méthode graphique donnant une approximation satisfaisante des pseudo pression et température critiques de gas quand uniquement la densité du gaz est connue
Mathematical correlation Mélanges de gaz naturels
TPC R 168 325 g 12.5 g2 PPC psia 677 15.0 g 37.5 g2 Mélanges de condensats (liquide)
TPC R 187 330 g 71.5 g2
PPC psia 706 51.7 g 11.1 g2 28 Corrélation graphique des pseudo propriétés critiques des gaz naturels
Exercice Déterminer la masse volumique du mélange gazeux suivant. Considérer le mélange parfait at 1000 psia et 100 °F.
Composant
yi
C1
0.75
C2
0.07
C3
0.05
C4
0.04
C5
0.04
C6
0.03
C7
0.02 29
Solution Composant
yi
MWi
y i MWi
TC i R
y i TC i
C1
0.75
16.04
12.030
343.5
257.6
673
504.7
C2
0.07
30.07
2.105
550.1
38.5
708
49.6
C3
0.05
44.10
2.205
666.2
33.3
617
30.9
C4
0.04
58.12
2.325
765.6
30.6
551
22.0
C5
0.04
72.15
2.886
847.0
33.9
485
19.4
C6
0.03
86.18
2.585
914.6
27.4
434
13.0
C7
0.02
100.21
2.004
972.8
19.5
397
7 .9
MWa 26.14 m RT PV ZnRT Z MW a
Ensuite, calculer
PPr
TPC 440.8
V ZRT m P MWa
P 1000 1.54 PPC 647.5
Figure ci dessus : Z = f(propriétés réduites)
Finalement :
PC i psia
et
PPC 647.5
g
TPr
y i PCi
1
P MWa ZRT
T (100 460) 1.27 TPC 440.8
Z 0.725
1000 x 26.14 g 6.00 lb / ft 3 0.725 x 10.73 x 560
30
Exercice Recalculer la masse volumique, de l’exercice précédent, en estimant les pseudo propriétés réduites.
Solution 1. Calculer la densité du mélange gazeux
g
MWa 26.14 0.903 29.96 29.96
2. Déterminer les pseudo propriétés critiques
TPC 168 325 x 0.903 12.5 x 0.9032 451 R
PPC 677 15.0 x 0.903 37.5 x 0.903 2 660 psia 3. Trouver les propriétés pseudo réduites
TPr
560 1.24 451
PPr
1000 1.52 660
4. Déterminer Z à partir de la figure utilisée précédement
Z 0.69
5. Finalement, calculer la masse volumique
g
1000 x 26.14 6.30 lb / ft 3 0.69 x10.73 x 560
31
Effet de composants non hydrocarbonés (CNH) sur Z Les gaz naturels contiennent souvent des CNH notamment: CO2 , N2 , et H2S. Les gaz hydrocarbonéssont classés comme suit: - doux : pas de sulphide d’hydrogène - acides : si [H2S] = 1 grain / 100 ft3
[NHC] ≤ 5% : la précision n’est pas sérieusement affectée [NHC] > 5% : jusqu’à 10 % Z peut être érroné, donc des corrections sont obligatoires.
32
Correction pour CNH Les CNH ont un net effet sur les propriétés des gaz puisque leur facteur de compressibilité a un comportement différent de celui des gaz doux. D’après Wichert et Aziz Ont développé une méthode précise pour le calcul de Z des gaz acides contenant jusqu’à 85% de composants acidiques, et ceci à l’aide de diagrammes standard du facteur de compressibilité des gaz. Ont défini un pseudo facteur d’ajustement de température critique pour ajuster (corriger) les pseudo propriétés critiques du mélange gazeux acide.
f ( CO2 , H 2 S )
' PC
T
TPC
and
PPC'
PPC TPC' TPC B(1 B)
120 ( A0.9 A1.6 ) 15 ( B 0.5 B 4.0 ) [R]
A yH 2 S yCO 2
A : sum of mole fractions of CO2 and H2S in mixture 33 B : mole fraction of H2S
Les étapes de calcul et d’introduction de
dans les calcul du facteur Z
Etape 1: Calculer les pseudo propriétés critiques du mélange de gaz Etape 2: Déterminer le facteur de correction (à partir du diagramme ci dessous ou le calculer à l’aide des équations ci dessus) Etape 3: Corriger PPC et
TPC (calculés à l’étape 1)
Etape 4: Calculer les pseudo propriétés réduites Etape 5: Lire le facteur de compressibilité à partir de la figure de Standing et Katz.
34
Facteur de correction de la pseudo température critique, in °R.
35
Exercice Déterminer la masse volumique d’un mélange gazeux acide, à 1000 psia et 110 °F , ayant la composition ci dessous et considéré idéal.
a. Sans correction due à la présence des CNH b. En utilisant la méthode de correction de Wichert-Aziz c. Que concluez-vous?
Composant
yi
CO2
0.10
H2 S
0.20
N2
0.05
C1
0.63
C2
0.02 36
Solution yi
MWi
yi MWi
PC i psia yi PC i
TC i R
yi TC i
CO2
0.10
44.01
4.401
1071
107.1
547.57
54.757
H2 S
0.20
34.08
6.816
1306
261.2
672 .37
134 .474
N2
0.05
28.01
1.401
493
24.65
227.29
11.365
C1
0.63
16.04
10.105
667
420 .714
343.06
216 .128
C2
0.02
30.07
0.601
707.8
14.156
549.78
11.00
Composant
MWa 23.324
827.82
427.72
Calculer la densité
23.324 g 0.8054 28.96 Ensuite, déterminer à partir de la table ci dessus
PPC 827.82 psia TPC 427.72 R 37
1. La masse volumique sans corrections
PPr
1000 1.208 827.82
TPr
570 1.333 427.72
A l’aide des pseudo propriétés réduites ci-dessus et la figure de Standing-Katz, le facteur Z est Z 0.820
Ensuite, calculer la masse volumique à l’aide de l’équation
g
1000 x 23.324 4.651 lb / ft 3 0.82 x10.73 x 570
1. La masse volumique avec corrections
B yH 2 S 0.2
A yCO2 yH 2 S 0.1 0.20 0.30
Déterminer le facteur de correction
120 ( 0.30 0.9 0.301.6 ) 15 ( 0.20 0.5 0.20 4.0 ) 29.86R ensuite, corriger la pseudo température critique
TPC' 427.72 29.86 397.86 R Après cela, calculer la pseudo pression critique corrigée
PPC'
827.82 x 397.86 727.07 psia 427.72 0.2 x (1 02) x 29.86
38
la pseudo pression reduite est alors égale à
P 1000 1.375 ' PPC 727.07
PPr
Et la pseudo température reduite
TPr
T 570 1.433 TPC' 397.86
finalement, à l’aide des pseudo properties reduites ci-dessus et la figure de Standing-Katz, Le nouveau facteur de compressibilité est
Z 0.837 Et la masse volumique correspondante est
g
1000 x 23.324 4.56 lb / ft 3 0.837 x10.73 x 570
Il y a environ 2 % d’erreur entre les valeurs corrigée et non corrigée. 39
-Carr, Kobayashi, et Burrows ont proposé une procédure simplifiée pour corriger les pseudo propriétés critiques des gaz naturels contenants des CNH. -La méthode est avantageuse lorsque la composition du mélange de gaz est inconnue. -Connaissant la densité du mélange gazeux, déterminer les pseudo température et pression critiques à l’aide de la dernière figure. Ensuite, ajuster, à l’aide des équations suivantes, les pseudo propriétés critiques estimées.
TPC' R TPC 80 yCO2 130 y H 2S 250 y N2 PPC' psia PPC 440 yCO2 600 y H 2S 170 y N2
40
Correction pour les gaz à MW élevé Aucun mélange de MW > 40 n’a été considéré dans la réalisation du diagramme, donc la figure ne peut être applicable aux mélange gazeux de MW > 40 .
Sutton à observé que les déviations sont associés aux mélanges ayant des concentrations élevées d’ heptanes-plus (C7+) , et proposa que les déviations peuvent être minimisées en utilisant les règles de mélange développées par Stuart et al., et des facteurs empiriques de correction liés à la présence de concentration d’heptanes-plus dans le mélange gazeux.
Diagramme de Standing-Katz facteur de compressibilité
41
Approche de correction proposée 1. Calculer les paramètres 0.5 TC 2 TC 1 J yi yi 3 i PC i 3 i PC i
K yi i
2
TC 0.5 PC i
Paramètre de corrélation de Stewart-Burkhardt-Voo
Paramètre de corrélation de Stewart-Burkhardt-Voo
R / psia
R / psia 0.5
2. Déterminer les paramètres de correction
J 0.6081FJ 1.1325 FJ 2 14.004 FJ yC 64.434 FJ yC2 7
7
2
0.5 1 TC 2 TC FJ y y 3 PC C 3 PC C7 7
T
K C0.5 (0.3129 yC 4.8156 yC2 27.3751 yC3 ) PC C 7
7
7
7
Température en [° R] , et Pression en [psia]
3. Corriger les paramètres J and K
K K K '
J ' J J 42
4. Déterminer les pseudo température et pression critiques ajustées
K
' 2
TPC
J
T
'
PPC
TPC ' J
P
5. Utiliser PC et PC calculées et suivre la procédure normale de Standing et Katz pour déterminer le facteur de compressibilité.
43
Analyse Mathématique du Diagramme de Standing-Katz du Facteur de Compressibilité Parfois il est plus pratique d’utiliser des équations mathématiques simples pour des calculs directs du facteur de compressibilité. Méthode de Papay - empirique - 4.8 % erreur
P Z 1 Pr TPr
PPr 0 . 36748758 0 . 04188423 TPr
Il existe d’autres méthodes plus compliquées nécissitant des solutions numériques.
44
La Compressibilité des gaz naturels - Indispensable dans les problèmes de reservoir engineering - Plus importante que celle des liquides - Pour un liquide elle est suffisament faible pour être négligée.
La compressibilité isotherme d’un gaz est le changement de volume par unité de volume par unité de changement de la pression
1 V Cg V P T
n RT Z V P Cg
in
1/ unit pressure
Differentiating
1 V nRT P T P
Z Z 2 P P
1 1 Z P Z P T
Gasz Idéal Z = 1 :
Cg
1 P
45
En termes de pseudo propriétés
Cg
Multiplier l’équation par
1 1 Z PPr PPC Z PPr PPC T Pr
PPC
C g PPC Cr
1 1 Z PPr Z PPr T Pr
Qui est la pseudo compressibilité reduite isotherme et définie comme
Cr C g PPC (Z / PPr )TPr peuvent être calculées à partir de la pente de l’isotherme TPr Les valeurs de du diagramme de Standing-Katz du facteur de compressibilité à la valeur d’intérêt.
46
Exercice Déterminer la compressibilité isotherme d’un mélange gazeux (composition ci dessous) à 1000 psia et 100°F, en considérant a. Un comportement idéal (parfait) b. Un comportement de gaz réel
Composant
yi
C1
0.75
C2
0.07
C3
0.05
n C4
0.04
n C5
0.04
C6
0.03
C7
0.02
47
Solution 1.
Comportement idéal Utiliser dirctement l’équation de Cg
2.
Cg
1 1 10 3 psia 1 P 1000
Gaz réel
a. Calculer
PPC 647.5 psia
b. Ensuite
PPr
1000 1.54 647.5
TPC 440.8 R TPr
(100 460) 1.27 440.8
c. A l’aide de la figure de Standing-Katz on obtient Z 0.725
et la pente
Z 0.17 P Pr TPr 1.27 d. Déterminer la pseudo compressibilité reduite isotherme
Cr
1 1 ( 0.17) 0.8808 1.54 0.725
e. Finallement, calculater la compressibilité du gaz
Cg
Cr 0.8808 1.361 x10 3 psia 1 PPC 647.5
48
L’exemple peut être résolu à l’aide du diagramme de Trube
Cr 0.90 Cg
Cr 0.90 1.390 x10 3 psia 1 PPC 647.5
Il existe d’autres méthode plus compliquée telle que la méthode de Mattar-Brar-Aziz (n’est pas donnée ici)
Pseudo compressibilité reduite des gaz naturels Diagramme de Trube
49
Facteur Acentrique Un troisième paramètre , le facteur acentrique développé par K. S. Pitzer en 1955, comme paramètre de corrélation pour caractériser la non sphéricité d'une molécule. Il a été largement accepté et considéré afin de surmonter certaine limites du principe des états correspondant. Définition du facteur acentrique
log 10 Prsat T
r
Prsat
Dépendence approximative de T = f(pression de vapeur)
Facteur acentrique moyen d’un mélange
0.7
1
Pv PC
est zéro pour l’argon, krypton, et xenon
D’après la théorie de Pitzer (états correspondants basés sur les 3 paramètres) tous les fluides ayant la même valeur ont la même valeur du facteur Z une fois comparés aux mêmes Pr et Tr .
m yi i 50
Pression de vapeur
(sera discutée en détails)
La pression de vapeur d’une substance est la pression exercée par sa phase vapeur en equilibre avec sa phase liquide ou solide à une température donnée.
Po int Critique C
P Pr ession P
Liquide
Liquide
Gas
Vapeur
T1
A
B
T2
T Correlation
Volume
T T ln PV 19 1 b 8.5 ln b T T
51
52
Pression de vapeur à basse température d’hydrocarbures légers
Pr ession de Vapeur [ psia ]
Temperature 53 F Pression de vapeur de composants d’hydrcarbures
Viscosité Résistance à l’écouement, égale au rapport de la contrainte de cisaillemnt (force tangentielle/unité de surface) sur le taux de cisaillement (gradient de vitesse local):
Fonction de la forme
g g ( P, T , yi )
Procédure de calcul Carr, Kobayashi, et Burrows ont développé des corrélations graphiques pour estimer la viscosité des gazs naturels en fonction de la pression, temperature et densité du gaz.
1. Chercher PPC et MWa , et corriger les si [NHC] > 5 moles pour cent 2. Utiliser la figure ci dessous pour déterminer la viscosité du gaz naturel à 1 atm et temperature d’intérêt. Cette viscosité, nommée 1 , doit être corrigée à cause de la présence des CNH (à l’aide des médaillons des figures). Les fractions des CNH tendent à augmenter la viscosité de la phase gazeuze, mathématiquement
1 1 u CO H S N 2
3. Déterminer les pseudo pression et temperature reduites
2
2
54
4. Déterminer
g
/ 1
à l’aide des pseudo propriétés reduites
g = viscosité du gaz aux conditions désirées.
Corrélation de rapport de viscosité de Carr 5. Finalement, calculater g à l’aide de
g
g 1 1
55
Corrélation de viscosité atmosphérique du gaz de Carr 56
. . .
G: specific gravity
Correction de viscosité due à la présence de H2S
57
Correction de viscosité due à la présence de CO2
58
Correction de viscosité due à la présence de N2
59
60
Viscosité de gaz en fonction de différentes variables
61
Viscosité de gaz en fonction de différentes variables
Herning et Zipperer ont proposé l’équation ci dessous pour estimer la viscosité de mélanges gazeux n
m
i 1 n
yi MWi
i
y i 1
i
MWi
62
Exercice Déterminer la viscosité du mélange gazeux à 3500 psia et 200 °F.
Composant
yi
N2
0.05
CO2
0.05
H2S
0.02
C1
0.80
C2
0.05
C3
0.03
63
Solution Dans ce cas il y a une correction à effectuer due à la présence des CNH.
1. Calculer :
MWa
g
MWa
y MW i
PPC i
TPC
19.97
i
g
g density of gas at temperature T and pressure P 19.97 0.689 density of air at temperature T and pressure P air 28.96
TPC 168 325 g 12.5 g2 380.43 R
PPC 677 15.0 g 37.5 g2 665.11 psia 2. Corriger les pseudo propriétés critiques calculer en 1. (à cause de la présence des CNH)
TPC' TPC 80 yCO2 130 y H 2S 250 y N2
TPC' 380.43 80 x 0.05 130 x 0.02 250 x 0.05 366.53 R
PPC' PPC 440 yCO2 600 yH 2 S 170 yN 2 PPC' 665.11 440 x 0.05 600 x 0.02 170 x 0.05 690.61 64 psia
3. A l’aide de la dernière figure de Carr, estimer la viscosité non corrigée à 1 atm et 200 °R
1 u
0.0123
4. Utiliser les figures médaillons (Carr) pour estimer
N
2
0.00042
CO
2
0.00026
H S 0.00005 2
5. Déterminer la viscosité corrigée du gaz à pression atmospherique température du système
1 0.0123 0.00042 0.00025 0.00005 0.01303 6. Déterminer
TPr
660 1.80 366.53
PPr
3500 5.07 690.61
7. A l’aide de la correlation graphique du rapport des viscosités de Carr estimer
g 1.52 1 Finalement, déterminer la viscosité du mélange gazeux
g 1
g
1 1.52 x 0.01303 0.01981
65
Exercice Calculer la viscosité d’un gaz naturel de densité 0.702 à 195 ° F et 1815 psia
66
Solution 1. Estimer les propriétés pseudo critiques à l’aide de la densité g 2. Chercher les propriétés réduites PR = (1815 / 669) = 2.72
;
TR = (195 + 460) / 390 = 1.68
3. Lire à partir des figures ci-dessus
g 1.28 1 1 0.012 Finalement
g g 1
1 1.28 x 0.012 0.0154 67
Exercice Déterminer le facteur de compressibilité du mélange gazeux acide ci dessous, à 2000 psia et 150 °F.
a. Sans correction due aux CNH b. Avec correction due aux CNH Que concluez vous? Expliquer.
Composant N2 CO2 H2S Méthane Ethane Pr opane i bu tan e n bu tan e i pen tan e n pen tan e n hexane n hep tan e n oc tan e n nonane n décane
fraction molaire 0.0345 0.0130 0.0000 0.8470 0.0586 0.0220 0.0035 0.0058 0.0027 0.0025 0.0028 0.0028 0.0015 0.0018 0.0015 68
Solution Sans correction MWa 19.91 ; m
19.91 0.686 29
PPC 663.3 psia
TPC 374.1 R
PPr
2000 3.02 663.3
TTr
(150 460) 610 1.63 374.1 374.1
Z 0.83 Avec correction Trouver le factor d ' ajustement de la T 120( A 0.9 A1.6 ) 15( B 0.5 B 4.0 )
120 0.0130 0.0000
0. 9
0.0130 0.0000 1. 6 0 2.29 R
TPC' TPC 374.1 2.29 371.81 R PPC'
PPC TPC' 663.3 x 371.81 659.24 psia TPC B(1 B) 374.1 0
PPr
2000 3.03 659.24
Donc , Z 0.84
TPr
150 460 1.64 371.81
69
Standing a proposé une autre méthode mathématique pour estimer la viscosité à pression atmosphérique et température du système :
1 1 u CO H S N 2
1 u
2
2
[1.709 x105 2.062 x106 g ] ( T 460 ) 8.188 x103 6.15 x103 log g
T = température du système en °R
1 u
N
2
CO
y N 2 8.48 x10 3 log ( g ) 9.59 x10 3
8.49 x10
3 3 y 9 . 08 x 10 log ( ) 6 . 24 x 10 CO2 g 2
H S y H S 2
2
3
log ( g ) 3.73 x10 3
Lee, Gonzalez, et Eakin ont proposé une expression semi empirique en termes de température du système et Mwa pour estimer la viscosité du gaz
g Y g 10 K exp X 62 . 4 4
g : en lb / ft à P et T du système 3
T : température du système MWa : MW apparent du mélange gazeux
X 3.5 K
,
986 0.01 MWa T
9.4 0.02 MWa T 1. 5 209 19 MWa T
Y 2.4 0.2 X
70
Dean et Stiel ont proposé une autre méthode mathématique pour estimer la viscosité du gaz naturel à pression atmosphérique et température du réservoir. 8/9 T 1 34 x 10 5 Pr
for TPr 1.5
m
1 m
166.8 x10 5 ( 0.1338 TPr 0.0932) 5 / 9
m
for TPr 1.5
Est une paramètre de viscosité défini comme suit:
1/ 6 TPC m 5.4402 2/3 MWa0. 5 PPC
Ils ont aussi préconisé
g 1 r
10.8 x10 5 exp 1.439 r exp 1.111 r1.888
0.27 PPr Z TPr
m
g : en à P et T du système 1 : en à 1 atm et T du système 71 r : masse volumique réduite du gaz
Viscosité de différents gaz à 1 atm
72
Densité
D e n s i t é
D e n s i t é
Viscosité de gaz d’hydrocarbures
73
Conductivité Thermique dT q k dx
Flux de chaleur du à la conduction
[ BTU / hr ft 2 ]
La conductivité thermique, pour des mélanges de gaz naturels à pression élevée, peut être estimée à partir d'une valeur atmosphérique et d'une correction de pression.
Example Déterminer la conductivité thermique d’un gaz naturel de MW = 25 à 700 psia et 300 °F.
Solution 1. Chercher les propriétés critiques
TC 440 R
PC 660 psia
2. Calculer les propriétés réduites
Tr
(300 460) 1.73 440
700 Pr 1.06 660 74
3. A l’aide de la figure ci-dessous déterminer la conductivité thermique kA à 1 atm
Conductivité thermique de gaz naturels et d'hydrocarbures at 1atm
k A 0.0248 Btu /[( hr . ft 2 .F ) / ft] or 0.0248 Btu . hr 1. ft 1.F 1
75
4. Déterminer le rapport
k 1.15 kA 5. Finalement, déterminer la k du gaz
k k k A 1.15 x 0.0248 0.0285 Btu hr 1 ft 1 F 1 kA
MELANGES Méthode de Stiel et Thodos : Lire, à partir des diagrammes, k de chaque composant à la T désirée. km est estimée à l’aide de la Règle Racine Cubique applicable aux mélanges se composant de gaz simples et pas de CO2.
km
yk y i
i
i 3
3
MWi
MWi
Rapport de conductivité thermiques de gaz 76
Rapport de conductivité thermique
k kA
77
Exercice 12.1 A l’aide de la méthode Stiel-Thodos, chercher la conductivité thermique du mélange gazeux à 200 °F et 1 atm.
Composant
yi
N2
0.05
CH 4
0.80
C2 H 6
0.15
78
Propriétés Thermodynamiques - Enthalpie • gaz parfaits • gaz réels
- Entropie - Chaleur spécifique
79
Correlation Enthalpique Définition
H U PV
dH dU d (PV ) Forme différentielle U, P, et V sont des fonctions d’états
H U (PV ) H : fonction d’état
-Apparait fréquement dans les écoulements -Le changement de l’enthalpie avec T et P est complexe -La procédure de prédiction de ΔH de substances pures ou de mélanges est basée uniquement sur des données expérimentales, donc, les diagrammes P- H sont très recommandés et utilisés.
80
Effet de pression sur l’enthalpie d’écoulement de gaz naturels
Gaz Réels L’enthalpie de mélanges de gaz réels et des liquides peut être estimée à l’aide de calculs manuels. Ceux recommandés pour l'usage sont basés sur une extension du principe des états correspondants et sont donnés dans les figures ci-dessous.
La correlation applicable aux mélanges gazeux et liquides se compose de deux parties: Changement d’enthalpie avec la pression pour un fluide simple (fluide avec facteur acentrique zéro),
Correction pour la déviation d'un fluide réel par rapport au changement enthalpique avec la pression d'un fluide idéal.
Effet de pression sur l’enthalpie (fluide Simple)
81
Effet de pression sur l’enthalpie (Correction pour fluides réels)
Enthalpies d’états idéaux (parfaits) Les enthalpies de beaucoup de substances gazeuzes pures sont aisément corrélées en série de puissance de la température. Les figures ci-dessous montrent des valeurs typiques d’enthalpie de composants de gaz naturel.
82
Enthalpie idéale (correspondant à l’état idéal) de composants purs
Mélanges La référence d’enthalpie choisie est l’enthalpie zéro à pression et température absolues nulles, c’est la même référence utilisée dans API Project 44.1. Le choix de la référence est arbitraire et représente un moyen de convenance. La valeur absolue de l’enthalpie ne présente pas d’intérêt ; seules, ses variations entre deux états sont recherchées, puisqu’elles fournissent la quantité de chaleur à fournir ou à extraire. Les différences d’enthalpie qui sont les valeurs d’intérêt, ne sont pas altérées par le choix de la référence. Cependant, la même enthalpie de référence doit être utilisée pour tous les composants dans tous les calculs. La variation d'enthalpie de mélanges de gaz réels est calculé à l'aide d'une corrélation préparée à partir de mesures expérimentales d'enthalpie d'une variété de mélanges.
H TP H 00 H T0 H 00 H T0 H TP
H TP
BTU / lb mole
: l’enthalpie à pression et température d’intérêt
H
0 T
H 00
: l’enthalpie idéale au dessus de la référence H
H
0 T
H TP
de l’enthalpie avec la pression, donné par la différence d’enthalpie entre l’enthalpie idéale :etChangement l’enthalpie à la pression désirée; les deux quantitée sont à la température.
0
, à la température d’intérêt
H 00 0 à la référence choisie, température absolute zéro ou
HH H H 0
0
H : enthalpie à T d ' int érêt 0
H : enthalpie idéale
HTP HT0 HT0 HTP 83
Méthode de Calcul
H
0
H
calculée à partir de
0 (') 0 0 H H H H 0 H H R TC R T R T C C
H
0
H / R TC
H
0
H / R TC
0
( ')
Variation d’enthalpie avec la pression d’un fluide simple (donné par fig. cidessus) Correction due à la déviation d'un fluide réel par rapport à la variation de l'enthalpie idéale avec la pression, donnée par les figures ci-dessus.
Pour pouvoir utiliser les figures de gaz réels ci-dessus : - La composition du mélange doit être connue - Les pseudo T et P critiques du mélange sont calculées à l’aide de la règle de Kay - L’enthalpie moyenne du mélange
H m0 yi Hi0 H i0 enthalpie idéale de composant pur i x MWi 84
Enthalpie de formation de différents gaz
85
Exemple Calculer l’enthalpie du mélange gazeux à 1010 psia et 120 °F.
Composant
yi
Méthane CO2
0.9010 0.0106
Ethane
0.0449
Pr opane i Bu tan e
0.0187 0.0065
n Bu tan e i Pen tan e
0.0045 0.0017
n Pen tan e Hexane
0.0019 0.0052
86
Solution. yi
MWi
TC R
PC psia
i
Méthane CO2
0.9010 0.0106
16.04 44.01
343.0 547.5
667.8 1071.0
0.0108 0.2667
292 100
Ethane
0.0449
30.07
549.8
707.8
0.0972
189
Pr opane i Bu tan e n Bu tan e
0.0187 0.0065 0.0045
44.10 58.12 58.12
665.7 734.6 765.3
616.3 529.1 550.7
0.1515 0.1852 0.1981
162 151 162
i Pen tan e n Pen tan e
0.0017 0.0019
72.15 72.15
828.7 845.3
490.4 488.6
0.2286 0.2510
151 158
Hexane
0.0052
86.18
912.0
470.0
0.2990
139
Composant
H i0 BTU / lb
m 0.0243
H 0 4857.31 BTU / lb mole
H i0 enthalpie idéale du composant i ( figure : ideal enthalpy of pure components)
87
1. Déterminer les pseudo température et pression critiques du mélange
PPC 666.47 psia
TPC 367.96 R
Présence de CNH (CO2 ), donc correction des pseudo paramètres critiques (c< 5% donc on peut ignorer la correction)
120 (0.01060.9 0.01061.6 ) 1.92
TPC' 367.96 1.92 366.04 R PPC'
666.47 x 366.04 662.99 psia 367.96
2. Déterminer les paramètres réduits
PPr
1010 1.52 662.99
TPr
(120 460) 1.59 366.04 88
3. Calculer
0
H0 H 0.68 R T C
H0 H R T C
( ')
0.015
et
0.0243
0 ( ') 0 0 H H H H 0 H H m R TC R T R T C C 1.987 x 366.04 x 0.68 (0.0243 x 0.015) 494.87 BTU / lb mole
4. Finalement, l’enthalpie du mélange est égale à l’enthalpie idéale moins l’enthalpie correspondant à la déviation par rapport à l’état idéal
H 0 H m 494.87 BTU / lb mole H m H 0 494.87 H m 4857.31 494.87 4362.44 BTU / lb mole 89
Correlation d’Entropie - Dépend des états initial et final, donc fonction d’état. - D’un point de vue microscopique: une augmentation d’entropie est associée à une augmentation de désordre (ou réduction d ‘ordre) au niveau moléculaire. - L'entropie est plus employée comme guide pour interpréter le comportement des gaz et des liquides dans les procédés de compression et d'expansion - Le changement de l'entropie de n'importe quel système subissant un processus réversible est égal à
dS
dQR T
or
S
dQR T
dQ : var iation d ' energie int erne L’entropie d’un mélange à multicomposants peut être évaluée en combinant l’entropie idéale (correspondant à l’état idéal) de API 44 avec les valeurs de variation de l’entropie avec la pression données par les tables de Curl et Pitzer. Il n’existe pas d’équations d’entropie pour les mélanges indéfinis (pseudo composants) mais, pour la plus part des cas où les pseudo composants sont présents en petite concentration, ils peuvent être approximés d'une manière satisfaisante par la paraffine hydrocarbonnée ayant le poids moléculaire le plus proche. 90
Méthode de calcul Similaire à celle de la correlation d’enthalpie 1. Calculer l’entropie idéale pour une phase fluide (gaz ou liquide) à une température donnée
Sm0 yi Si 0 R yi ln yi
S i 0 : entropie idéale de i donnée par la figure
91
Entropie idéale de composants purs
2. L’effet de la pression (pour une T donnée) est calculée à l’aide dela correlation de Pitzer:
S
0
S
m
S 0 S 0 R R
S0 S R
( ')
Ln P [atm]
S 0 S R
0
S 0 S R
( ')
92
Effet de pression sur l’entropie pour un fluide simple
Effet de pression sur l’entropie (Correction pour fluide réel)
Example Calculer l’entropie du mélange gazeux 1010 psia et 120 °F, (exemple précédent) yi
MWi
TC R
PC psia
i
Methane CO2
0.9010 0.0106
16.04 44.01
343.0 547.5
667.8 1071.0
0.0108 0.2667
3.150 1.176
Ethane
0.0449
30.07
549.8
707.8
0.0972
2.036
Pr opana i Bu tan e n Bu tan e
0.0187 0.0065 0.0045
44.10 58.12 58.12
665.7 734.6 765.3
616.3 529.1 550.7
0.1515 0.1852 0.1981
1.624 1.400 1.338
i Pen tan e n Pen tan e
0.0017 0.0019
72.15 72.15
828.7 845.3
490.4 488.6
0.2286 0.2510
1.260 1.245
Hexane
0.0052
86.18
912.0
470.0
0.2990
1.198
Component
m 0.0243
S i 0 BTU / lb R
S 0 51.9016 BTU / lb mole R
S i0 Entropie idéale de i ( figure ideal entropy of pure components) 93
1. Determiner les pseudo temperature et pression critiques du mélange
PPC 666.47 psia
TPC 367.96 R
Presence de NHCs (CO2 ), donc correction (c< 5% donc on peut ignorer la correction)
120 (0.0106 0.9 0.01061.6 ) 1.92R
TPC' 367.96 1.92 366.04 R PPC'
666.47 x 366.04 662.99 psia 367.96
2. Déterminer les paramètres réduits
PPr
1010 1.52 662.99
TPr
(120 460) 1.59 366.04 94
3. A l’aide des deux dernières figures
S0 S R
0
S0 S 0.345 R
( ')
0.065
4. Facteur acentrique apparent du mélange
0.0243 5. Déterminer la différence d’entropie entre les états idéal et reel
S
0
S
m
( ') S 0 S 0 S 0 S Ln P R R R 1010 1.987 0.345 0.0243 0.065 ln 14.7 9.093 BTU / lb mole R
6. Trouver l’entropie idéale pour le mélange
Sm0 yi Si 0 R yi ln yi
(Note the Napierian logarithm)
S m0 51.9016 ( 0.920) 52.8216 BTU / lb mole R 7. Finalement, l’entropie du mélange est égale à l’entropie idéale moins l’entropie correspondant à la déviation de l’état idéal , ou bien utiliser l’équation
S m at P , T S m0 S 0 S
m
S m 52.8216 9.093
43.7286 BTU / lb mole R
95
Chaleur Spécifique Quantité de chaleur nécessaire pour augmenter la température de un degré d’une masse donnée d’un matériau.
dQ n C dT
or
Chaleur spécifique molaire
dQ m C dT Chaleur spécifique massique, Chaleur Spécifique
Définie pour seulement deux chemins différents : pression constante et volume constant :
mesurée à pression constante
CV
mesurée à volume constant
96
- Substance Homogène : Chaleur spécifique = f ( P,T ) -Chaleurs spécifiques idéales sont de bonnes approximations pour les chaleurs -spécifiques de gaz réels à faibles pressions. -Chaleurs spécifiques idéales sont fonction de la température seulement -(indépendentes de la pression)
' T T 2
(A) ( ' ) : idéal
' a b T c T
C C R ' P
' V
2
(B)
Connaissant la dépendence de la température de l’une on trouvera celle de l’autre
97
Relation - CV
dH dU R dT dU CV dT at cst V C P CV R dH C p dT at cst P
98
Equation (A)
BTU /lb mole F
or
cal /g mole C
Constants for the molar heat capacity equation of organic gases in the ideal gas state
99
Equation (B)
BTU /lb mole F
or
cal /g mole C
Constants for the molar heat capacity equationof inorganic gases in the ideal gas state
100
Frequently asked to evaluate T
' ' C dT C P mean T T0 P T0
T
' C P dT
C P' mean
T0
T
T0
The base temperature is taken at a constant value such as 25°C and mean is determined as a function of the upper limit of integration .
' mean
is on next figures
e.g. : for CO2 : 12.1 BTU/lb-mole °F read at 2000 °F is the mean value between 77 and 2000 °F.
Gas Mixtures
C P' , m
i
yi C P' , i 101
Mean molar heat capacities of gases in the ideal gas state
Base temperature = 77 °F
102
Mean molar heat capacities of gases in the ideal gas state
Base temperature = 77 °F
103
104
Specific heat of hydrocarbon gases
Specific heat of hydrocarbon liquids
105
Exercise 15.1 Write the methane equation given below in of the following temperature units: a. °C, b. °R, c. °F. The molar heat capacity of methane in the zero-pressure state is given by the equation
' 3.381 18.044 x10 3 T 4.300 x10 6 T 2 Hint : T ( K ) = T( °R ) / 1.8 T ( K ) = [T( °F ) + 460] / 1.8 T ( K ) = T ( °C ) + 273
Answer a. C P' 7.99 15.70 x 10 3 T 4.300 x 10 6 T 2 b . C P' 3.381 10.03 x 10 3 T 1.327 x 10 6 T 2 c . C P' 7.79 8.81 x 10 3 T 1.327 x 10 6 T 2
106
Mid Term Exam Ex. 01 a. Expliquer brièvement et clairement ce qu’un point critique d’un gaz. b. When can it be said that two systems are in corresponding states. Explain using an example. c. Expliquer brièvement l’importance du facteur acentrique par rapport au principe des états correspondants..
Ex.02 Calculate the density of the following gas mixture at 1000 psia and 120 °F
Component
yi
CO2
0.10
H2S
0.15
C1
0.63
C2
0.02
C3
0.05
C4
0.05
Ex.03 Use the equations given below to calculate the heat required in to raise the temperature of ethane from 500 to 1000 °F in a flow process at a pressure of approximately 1 atm.
Q H
T2
' C P dT T1
107
Mid Term Exam Correction Ex.01 Component CO2 H 2S C1 C2 C3 n C4
yi
MWi
yi MWi
TCi R
yi TC i
PC i psia
yi PC i
0.10 0.15
44.01 34.08
4.401 5.112
547.91 672.45
54.791 100.868
1071 1300
107.100 195.000
0.63 16.043 0.02 30.07
10.107 0.601
343.33 549.92
216.298 10.998
666.4 706.5
419.832 14.130
0.05 44.097 0.05 58.123
2.205 666.06 33.303 2.906 765.62 38.281 MWa 25.336 TPC 454.539 R
616.0 550.6 PPC
30.800 27.530 794.392 psia
B yH 2 S 0.15 A yH 2 S yCO2 0.15 0.1 0.25 1. Adjustment factor
120 ( A0.9 A1.6 ) 15 ( B 0.5 B 4.0 ) 120 ( 0.250.9 0.251.6 ) 15 ( 0.150.5 0.15 4.0 ) 27.205 R 2. Corrected pseudo critical properties TPC' 454.539 27.205 427.334 R ' PC
P
TPC
PPC TPC' 794.392 x 427.334 741.190 psia B (1 B ) 454.539 0.15 (1 0.15 ) x 27.205
108
3. Reduced properties
PPr
(120 460) 1000 1.349 ; TPr 1.357 741.190 427.334
4. Find compressibility factor fro Standing-Katz chart
Z 0.81 5. Finally calculate the density
g
P MWa 1000 x 25.336 5.026 lb / ft 3 Z RT 0.81 x10.73 x (120 460)
with
psia . ft 3 R 10.73 lb mole.R
109
Ex.02
ETHANE C P' 2.247 38.201 x10 3 T 11.049 x10 6 T 2
T K
The required heat to raise temperature from T1 to T2
Q H
T2
' C P dT T1
Q H
T2
(2.247 38.201 x 10 3 T 11.049 x 10 6 T 2 ) dT
T1
811
2 3 3 T 6 T Q H 2.247 T 38.201 x 10 11.049 x 10 2 3 533
Q H 6354.35 cal / g mole 110