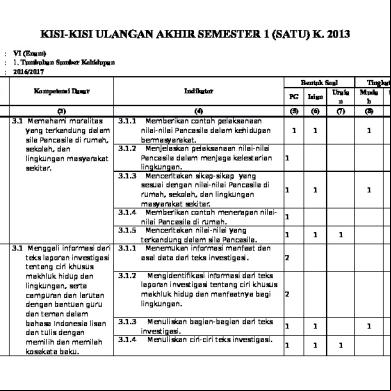
Apa Pengertian Kation Dan Anion 72g62
This document was ed by and they confirmed that they have the permission to share it. If you are author or own the copyright of this book, please report to us by using this report form. Report 2z6p3t
Overview 5o1f4z
& View Apa Pengertian Kation Dan Anion as PDF for free.
More details 6z3438
- Words: 1,682
- Pages: 7
Apa pengertian kation dan anion BY TATANG · OCTOBER 7, 2015
Kation adalah ion yang bermuatan positif. Ion ini terjadi karena atom netral melepaskan elektron pada kulit terluarnya (kulit valensi). Peristiwa ini menyebabkan jumlah proton lebih banyak daripada jumlah elektron sehingga bermuatan positif. Dalam sistem periodik unsur, kecenderungan atom-atom yang berada pada sisi kiri , golongan IA dan IIA, membentuk ion positif. Pada golongan IA akan membentuk kation bermuatan +1, contoh: Na+, Li+, dan K+ . Pada golongan IIA akan membentuk kation bermuatan +2, contoh: Ba+2, Mg+2, dan Ca+2. Anion adalah ion yang bermuatan negatif. Ion ini terjadi karena atom netral menerima elektron. Peristiwa ini menyebabkan jumlah elektron lebih banyak daripada jumlah proton sehingga bermuatan negatif. Dalam sistem periodik unsur, kecenderungan atom-atom yang berada pada sisi kanan , golongan VIA dan VIIA, membentuk ion negatif. Pada golongan VIA akan membentuk anion bermuatan -2, contoh: O2- dan S2- . Pada golongan VIIA akan membentuk anion bermuatan -1, contoh: F–, Cl–, Br– dan I–. Senyawa ion adalah senyawa yang terbentuk dari unsur logam (sebagai kation) dengan non logam (sebagai anion) menggunakan ikatan ion (serah terima elektron). Beberapa juga ada yang terbentuk dari kation (ion positif) yang gabungan unsur non logam seperti kation amonium (NH4+). Senyawa ionik adalah senyawa kimia yang terbentuk oleh muatan listrik yang dimiliki oleh masing-masing ion atom penyusunnya. Biasanya, senyawa ionik terdiri dari unsur logam bermuatan positif dan non logam bermuatan negatif dan membentuk struktur kristal.
Perbedaan Kation dan Anion Oleh: Dadan Ahmad | Diperbaharui: 23 June, 2016 Mungkin masih ada yang agak bingung atau mungkin sering tertukar dalam membedakan antara kation dan anion. Berikut ini merupakan ulasan tentang perbedaan kation dan anion yang mungkin bisa sedikit membantu atau bisa memberi sedikit pencerahan dalam membedakan kation dan anion tersebut.
Anion adalah senyawa ion yang punya muatan negatif atau bisa disebut ion negatif. Demikian juga dengan kation, kation adalah senyawa ion yang bermuatan positif. Anion dan kation bisa terbentuk dari unsur (monoatomik) maupun dari senyawa (poliatomik). Anion dan Kation terbentuk dari reaksi ionisasi. Contohnya Anion dan Kation sobat, misalnya, atom Kalium melepaskan satu elektron menjadi ion Ka+ (persamaan reaksinya, Ka → Ka+ + e–). Anion terjadi apabila atom unsur menangkap satu atau lebih elektron, misalnya, atom klor menangkap satu elektron menjadi ion Cl– (persamaan reaksinya, Cl + e– → Cl–). Jika atom kehilangan satu atau lebih elektron, maka atom tersebut akan bermuatan positif dan dinamakan kation. Sedangkan jika atom mempunyai satu atau lebih elektron ekstra maka akan bermuatan negatif dan disebut sebagai anion. Contoh pembentukan kation : Litium mempnyai 3 proton dan 3 elektron. Ketika kehilangan salah satu elektronnya, maka litium hanya mempunyai 2 elektron dan 3 proton. Maka litium akan membentuk kation (bermuatan positif). ment
Contoh pembentukan anion. Klor mempunyai 17 proton dan 17 elektron. Ketika bereaksi, klor mendapat 1 elektron dari atom unsur lainnya. Maka dari itu, sekarang klorin mempunyai 17 proton dan 18 elektron. Maka dari itu klorin membentuk anion (bermuatan negatif).
Anion yang bermuatan negatif mempunyai ukuran yang lebih besar daripada atom asalnya. Karena anion kelebihan elektron, maka elektron
tesebut saling tolak menolak satu sama lain dan maka dari itu menambah ukuran fisik dari ion. Ukuran ion ditentukan oleh awan elektron. Dan pada umumnya kation berukuran lebih kecil daripada atom asal dikarenakan kecilnya ukuran awan elektron. Kation hidrogen (H+ / hidronium) tidak mempunyai elektron, maka dari itu kation hidrogen jauh lebih kecil dari atom unsur hydrogen
Tabel Kation dan Anion Posted: October 8, 2011 in Uncategorized
9 Berikut ini adalah tabel beberapa kation monoatom (satu atom) umum dan beberapa anion monoatom umum yang sering digunakan para ahli kimia.
Beberapa Kation Monoatom Umum Golongan
Unsur
Nama Ion
Simbol Ion
Litium
Kation Litium
Li+
Natrium
Kation Natrium
Na+
Kalium
Kation Kalium
K+
Berilium
Kation Berilium
Be2+
Magnesium
Kation Magnesium
Mg2+
Kalsium
Kation Kalsium
Ca2+
Stronsium
Kation Stronsium
Sr2+
Barium
Kation Barium
Ba2+
IB
Perak
Kation Perak
Ag+
IIB
Seng
Kation Seng
Zn2+
IIIA
Aluminium
Kation Aluminium
Al3+
IA
IIA
Beberapa Anion Monoatom Umum Golongan
Unsur
Nama Ion
Simbol Ion
Nitrogen
Anion Nitrida
N3-
Fosfor
Anion Fosfida
P3-
Oksigen
Anion Oksida
O2-
Belerang
Anion Sulfida
S2-
Fluorin
Anion Fluorida
F–
Klorin
Anion Klorida
Cl–
Bromin
Anion Bromida
Br–
Iodin
Anion Iodida
I–
VA
VIA
VIIA
Hilanganya sejumlah elektron dari anggota unsur logam transisi (unsur golongan B) lebih sukar ditentukan. Faktanya, banyak dari unsur ini kehilangan sejumlah elektron yang bervariasi, sehingga dapat membentuk dua atau lebih kation dengan muatan yang berbeda. Muatan listrik yang dimiliki ataom disebut denganbilangan oksidasi. Banyak dari ion transisi (unsur golongan B) memiliki bilangan oksidasi yang bervariasi. Berikut adalah tabel yang menunjukkan beberapa logam transisi umum dengan bilangan oksidasi yang bervariasi.
Beberapa Logam Umum yang Memiliki Lebih dari Satu Bilangan Oksidasi Golongan
Unsur
VIB
Kromium
Nama Ion
Simbol Ion
Krom (II) atau Kromo
Cr2+
Krom (III) atau Kromi
Cr3+
Mangan (II) atau Mangano Mn2+ VIIB
Mangan
Mangan (III) atau Mangani
Mn3+
Besi (II) atau Fero
Fe2+
Besi (III) atau Feri
Fe3+
Kobalt (II) atau Kobalto
Co2+
Kobalt (III) atau Kobaltik
Co3+
Tembaga (I) atau Cupro
Cu+
Tembaga (II) atau Cupri
Cu2+
Merkuri (I) atau Merkuro
Hg22+
Merkuri (II) atau Merkuri
Hg2+
Timah (II) atau Stano
Sn2+
Timah (IV) atau Stani
Sn4+
Besi VIIIB Kobalt
IB
IIB
Tembaga
Raksa
Timah IVA
Timbal (II) atau Plumbum Pb2+ Timbal Timbal (IV) atau Plumbik
Pb4+
Kation-kation tersebut dapat memiliki lebih dari satu nama. Cara pemberian nama suatu kation adalah dengan menggunakan nama logam dan diikuti oleh muatan ion yang dituliskan dengan angka Romawi di dalam tanda kurung. Cara lama pemberian nama suatukation adalah menggunakan akhiran –o dan –i. Logam denganbilangan oksidasi rendah diberi akhiran –o. Sementara, logam dengan bilangan oksidasi tinggi diberi akhiran –i. Ion tidak selalu monoatom yang tersusun atas hanya satu atom. Ion dapat juga berupa poliatom yang tersusun oleh sekelompok atom. Berikut ini adalah beberapa ion poliatom penting yang disajikan dalam bentuk tabel.
Beberapa Ion Poliatom Penting Nama Ion
Simbol Ion 2-
Nama Ion
Simbol Ion
Sulfat
SO4
Hidrogen Fosfat
HPO42-
Sulfit
SO32-
Dihidrogen Fosfat
H2PO4–
Nitrat
NO3–
Bikarbonat
HCO3–
Nitrit
NO2–
Bisulfat
HSO4–
Hipoklorit
ClO–
Merkuri (I)
Hg22+
Klorit
ClO2–
Amonia
NH4+
Klorat
ClO3–
Fosfat
PO43-
Perklorat
ClO4–
Fosfit
PO33-
Asetat
CH3COO–
Permanganat
MnO4–
Kromat
CrO42-
Sianida
CN–
Dikromat
Cr2O72-
Sianat
OCN–
Arsenat
AsO43-
Tiosianat
SCN–
Oksalat
C2O42-
Arsenit
AsO33-
Tiosulfat
S2O32-
Peroksida
O22-
Hidroksida
OH–
Karbonat
CO32-
Untuk menghapal unsur golongan VIII A yang terdiri dari unsur Helium, Neon, Argon, Kripton, Xenon dan Rn. Untuk memudahkan menghapal dibuatlah kalimat, yaitu: hehoh negara argentina karena xenat runtuh.
Golongan VIIA disebut juga golongan halogen yang terdiri dari F, Cl, Br, I, At. dapat diingat dengan kalimat Fiska n Clara Baru Ingat Ateng
Golongan VI A yang terdiri dari O, S, Se, Te, Po. Dapat diingat dengan kalimat: Orang Sunda Seneng TemPo
Golongan V A yang terdiri dari N,P,As,Sb,Bi. Dapat diingat dengan kalimat : Nitra Photo Arek Anti Bisma
Golongan IVA yang terdiri dari C, Si, Ge, Sn dapat diingat dengan kalimat Cucu Simbah Geli di Sun
Golongan IIIA disebut juga golongan boron yang terdiri dari Unsur B Al Ga In Tl. Untuk memudahkan menghapal dibuatlah kalimat Bagas Al irsyadi Ganteng In Tlek
Golongan IIA disebt golongan Alkali Tanah yang terdiri dari Unsur Be, Mg, Ca, Sr, Ba, Ra. cara mennghafalnya Bebek Mangan Cacing Seret Banget Rasane
Golongan IA terdiri dari H, Li, Na, K, Rb, Cs, Fr. Untuk menghafalnya dibuat kalimat: Halinah Kawin,Rubi Cs Frustrasi
Contoh Kation dan Anion Beberapa contoh kation dan anion dapat kamu lihat pada tabel berikut ini.
Tabel: Contoh Kation dan Anion
Kation (ion positif) dan anion (ion negatif) dapat bergabung membentuk senyawa ion yang disebut senyawa ionik. Senyawa ionik dapat menghantarkan listrik.
Contoh Senyawa Ion Contoh yang paling sederhana adalah senyawa natrium klorida (NaCl) atau garam dapur yang terdiri dari ion Na+ dan ion Cl-. Ion Na+ dan ion Cl- akan tarik-menarik membentuk suatu senyawa NaCl (garam dapur) karena terdiri dari dua buah muatan listrik yang berlawanan. Untuk menguraikan senyawa NaCl ini menjadi unsur-unsur pembentuknya dapat dilakukan dengan cara mengalirkan arus listrik ke dalam lelehan natrium klorida (NaCl) sehingga NaCl ini akan terurai menjadi ion Na+ dan ion Cl-. NaCl ==> Na+ + ClNatrium Klorida Natrium + Klor (Senyawa Ionik) (Ion Natrium) (Ion Klorida)
Uji Nyala Uji warna nyala pada logam ini prinsimnya sangat sederhana, yaitu mengamati warna nyala yang dihasilkan ketika suatu senyawa logam dibakar. Pembakaran ini biasanya menggunakan api berwarna biru yang biasanya diperoleh dari pembakaran spirtus.
Teknik Analisa Uji Nyala Logam ini merupakan cara klasik dalam menganalisa senyawa, namun masih sangat efektif digunakan hingga saat ini. Selain efektif, uji nyala ini juga mamilki kelebihan yaitu murah biayanya. Alat yang digunakan dalam praktikum uji nyala logam ialah kawat nikrom(yaitu alloy nikel-kromium) ataupu kawat platina seperti pada gambar; Kawat ini digunakan karena kedua kawat tersebut tidak akan memberi warna ketika dibakar.
Dasar Teori Uji Warna Nyala Setiap unsur mempunyai ciri serta karakteristik yang berberbeda, seperti logam-logam kelompok alkali dan alkali tanah yang memberi beberapa warna yang khas jika dibakar.
Salah satu alasan warna yang khas ini muncul ialah karena konfigurasi atom-atom itu karena tiaptiap atom mempunyai konfigurasi yang berlainan dan karakteristik atau sifat-sifat khas dari kelompok itu. Warna nyala dihasilkan darireaksi kimia pergerakan elektron dalam ion-ion logam yang ada dalam senyawa. Masing-masing perpindahan elektron ini melibatkan beberapa energi dilepaskan sebagai energi sinar dengan panjang gelombang yang khas. Panjang gelombang yang spesifik inilah yang menyebabkan perbedaan warna sinar yang dihasilkan. Besarnya energi yang dihasilkan dari lompatan/perpindahan elektron ini beragam antara satu ion logam dengan ion logam lainnya. Ini berarti bahwa tiap-tiap logam akan mempunyai pola garis-garis spektrum yang berbeda dan menghasilkan warna nyala yang tidak sama pula
Prosedur Praktikum Uji Warna Nyala Prosedur uji kualitatif Nyala Logam ini sangatlah sederhana dan dapat dilakukan oleh siapapun, yaitu sebagai berikut:
1. Bersihkan sebuah kawat dengan mencelupkannya ke dalam asam hidroklorat pekat 2. Panaskan pada Bunsen. Ulangi prosedur ini sampai kawat tidak menimbulkan warna pada nyala api Bunsen. 3. Basahi kawat dengan asam dan kemudian celupkan ke dalam sedikit bubuk padatan yang akan diuji sehingga ada beberapa bubuk padatan yang menempel pada kawat tersebut. 4. Bakar kawat pada nyala Bunsen. 5. Ulangi prosedur dari awal jika warna nyala memudar
Kation adalah ion yang bermuatan positif. Ion ini terjadi karena atom netral melepaskan elektron pada kulit terluarnya (kulit valensi). Peristiwa ini menyebabkan jumlah proton lebih banyak daripada jumlah elektron sehingga bermuatan positif. Dalam sistem periodik unsur, kecenderungan atom-atom yang berada pada sisi kiri , golongan IA dan IIA, membentuk ion positif. Pada golongan IA akan membentuk kation bermuatan +1, contoh: Na+, Li+, dan K+ . Pada golongan IIA akan membentuk kation bermuatan +2, contoh: Ba+2, Mg+2, dan Ca+2. Anion adalah ion yang bermuatan negatif. Ion ini terjadi karena atom netral menerima elektron. Peristiwa ini menyebabkan jumlah elektron lebih banyak daripada jumlah proton sehingga bermuatan negatif. Dalam sistem periodik unsur, kecenderungan atom-atom yang berada pada sisi kanan , golongan VIA dan VIIA, membentuk ion negatif. Pada golongan VIA akan membentuk anion bermuatan -2, contoh: O2- dan S2- . Pada golongan VIIA akan membentuk anion bermuatan -1, contoh: F–, Cl–, Br– dan I–. Senyawa ion adalah senyawa yang terbentuk dari unsur logam (sebagai kation) dengan non logam (sebagai anion) menggunakan ikatan ion (serah terima elektron). Beberapa juga ada yang terbentuk dari kation (ion positif) yang gabungan unsur non logam seperti kation amonium (NH4+). Senyawa ionik adalah senyawa kimia yang terbentuk oleh muatan listrik yang dimiliki oleh masing-masing ion atom penyusunnya. Biasanya, senyawa ionik terdiri dari unsur logam bermuatan positif dan non logam bermuatan negatif dan membentuk struktur kristal.
Perbedaan Kation dan Anion Oleh: Dadan Ahmad | Diperbaharui: 23 June, 2016 Mungkin masih ada yang agak bingung atau mungkin sering tertukar dalam membedakan antara kation dan anion. Berikut ini merupakan ulasan tentang perbedaan kation dan anion yang mungkin bisa sedikit membantu atau bisa memberi sedikit pencerahan dalam membedakan kation dan anion tersebut.
Anion adalah senyawa ion yang punya muatan negatif atau bisa disebut ion negatif. Demikian juga dengan kation, kation adalah senyawa ion yang bermuatan positif. Anion dan kation bisa terbentuk dari unsur (monoatomik) maupun dari senyawa (poliatomik). Anion dan Kation terbentuk dari reaksi ionisasi. Contohnya Anion dan Kation sobat, misalnya, atom Kalium melepaskan satu elektron menjadi ion Ka+ (persamaan reaksinya, Ka → Ka+ + e–). Anion terjadi apabila atom unsur menangkap satu atau lebih elektron, misalnya, atom klor menangkap satu elektron menjadi ion Cl– (persamaan reaksinya, Cl + e– → Cl–). Jika atom kehilangan satu atau lebih elektron, maka atom tersebut akan bermuatan positif dan dinamakan kation. Sedangkan jika atom mempunyai satu atau lebih elektron ekstra maka akan bermuatan negatif dan disebut sebagai anion. Contoh pembentukan kation : Litium mempnyai 3 proton dan 3 elektron. Ketika kehilangan salah satu elektronnya, maka litium hanya mempunyai 2 elektron dan 3 proton. Maka litium akan membentuk kation (bermuatan positif). ment
Contoh pembentukan anion. Klor mempunyai 17 proton dan 17 elektron. Ketika bereaksi, klor mendapat 1 elektron dari atom unsur lainnya. Maka dari itu, sekarang klorin mempunyai 17 proton dan 18 elektron. Maka dari itu klorin membentuk anion (bermuatan negatif).
Anion yang bermuatan negatif mempunyai ukuran yang lebih besar daripada atom asalnya. Karena anion kelebihan elektron, maka elektron
tesebut saling tolak menolak satu sama lain dan maka dari itu menambah ukuran fisik dari ion. Ukuran ion ditentukan oleh awan elektron. Dan pada umumnya kation berukuran lebih kecil daripada atom asal dikarenakan kecilnya ukuran awan elektron. Kation hidrogen (H+ / hidronium) tidak mempunyai elektron, maka dari itu kation hidrogen jauh lebih kecil dari atom unsur hydrogen
Tabel Kation dan Anion Posted: October 8, 2011 in Uncategorized
9 Berikut ini adalah tabel beberapa kation monoatom (satu atom) umum dan beberapa anion monoatom umum yang sering digunakan para ahli kimia.
Beberapa Kation Monoatom Umum Golongan
Unsur
Nama Ion
Simbol Ion
Litium
Kation Litium
Li+
Natrium
Kation Natrium
Na+
Kalium
Kation Kalium
K+
Berilium
Kation Berilium
Be2+
Magnesium
Kation Magnesium
Mg2+
Kalsium
Kation Kalsium
Ca2+
Stronsium
Kation Stronsium
Sr2+
Barium
Kation Barium
Ba2+
IB
Perak
Kation Perak
Ag+
IIB
Seng
Kation Seng
Zn2+
IIIA
Aluminium
Kation Aluminium
Al3+
IA
IIA
Beberapa Anion Monoatom Umum Golongan
Unsur
Nama Ion
Simbol Ion
Nitrogen
Anion Nitrida
N3-
Fosfor
Anion Fosfida
P3-
Oksigen
Anion Oksida
O2-
Belerang
Anion Sulfida
S2-
Fluorin
Anion Fluorida
F–
Klorin
Anion Klorida
Cl–
Bromin
Anion Bromida
Br–
Iodin
Anion Iodida
I–
VA
VIA
VIIA
Hilanganya sejumlah elektron dari anggota unsur logam transisi (unsur golongan B) lebih sukar ditentukan. Faktanya, banyak dari unsur ini kehilangan sejumlah elektron yang bervariasi, sehingga dapat membentuk dua atau lebih kation dengan muatan yang berbeda. Muatan listrik yang dimiliki ataom disebut denganbilangan oksidasi. Banyak dari ion transisi (unsur golongan B) memiliki bilangan oksidasi yang bervariasi. Berikut adalah tabel yang menunjukkan beberapa logam transisi umum dengan bilangan oksidasi yang bervariasi.
Beberapa Logam Umum yang Memiliki Lebih dari Satu Bilangan Oksidasi Golongan
Unsur
VIB
Kromium
Nama Ion
Simbol Ion
Krom (II) atau Kromo
Cr2+
Krom (III) atau Kromi
Cr3+
Mangan (II) atau Mangano Mn2+ VIIB
Mangan
Mangan (III) atau Mangani
Mn3+
Besi (II) atau Fero
Fe2+
Besi (III) atau Feri
Fe3+
Kobalt (II) atau Kobalto
Co2+
Kobalt (III) atau Kobaltik
Co3+
Tembaga (I) atau Cupro
Cu+
Tembaga (II) atau Cupri
Cu2+
Merkuri (I) atau Merkuro
Hg22+
Merkuri (II) atau Merkuri
Hg2+
Timah (II) atau Stano
Sn2+
Timah (IV) atau Stani
Sn4+
Besi VIIIB Kobalt
IB
IIB
Tembaga
Raksa
Timah IVA
Timbal (II) atau Plumbum Pb2+ Timbal Timbal (IV) atau Plumbik
Pb4+
Kation-kation tersebut dapat memiliki lebih dari satu nama. Cara pemberian nama suatu kation adalah dengan menggunakan nama logam dan diikuti oleh muatan ion yang dituliskan dengan angka Romawi di dalam tanda kurung. Cara lama pemberian nama suatukation adalah menggunakan akhiran –o dan –i. Logam denganbilangan oksidasi rendah diberi akhiran –o. Sementara, logam dengan bilangan oksidasi tinggi diberi akhiran –i. Ion tidak selalu monoatom yang tersusun atas hanya satu atom. Ion dapat juga berupa poliatom yang tersusun oleh sekelompok atom. Berikut ini adalah beberapa ion poliatom penting yang disajikan dalam bentuk tabel.
Beberapa Ion Poliatom Penting Nama Ion
Simbol Ion 2-
Nama Ion
Simbol Ion
Sulfat
SO4
Hidrogen Fosfat
HPO42-
Sulfit
SO32-
Dihidrogen Fosfat
H2PO4–
Nitrat
NO3–
Bikarbonat
HCO3–
Nitrit
NO2–
Bisulfat
HSO4–
Hipoklorit
ClO–
Merkuri (I)
Hg22+
Klorit
ClO2–
Amonia
NH4+
Klorat
ClO3–
Fosfat
PO43-
Perklorat
ClO4–
Fosfit
PO33-
Asetat
CH3COO–
Permanganat
MnO4–
Kromat
CrO42-
Sianida
CN–
Dikromat
Cr2O72-
Sianat
OCN–
Arsenat
AsO43-
Tiosianat
SCN–
Oksalat
C2O42-
Arsenit
AsO33-
Tiosulfat
S2O32-
Peroksida
O22-
Hidroksida
OH–
Karbonat
CO32-
Untuk menghapal unsur golongan VIII A yang terdiri dari unsur Helium, Neon, Argon, Kripton, Xenon dan Rn. Untuk memudahkan menghapal dibuatlah kalimat, yaitu: hehoh negara argentina karena xenat runtuh.
Golongan VIIA disebut juga golongan halogen yang terdiri dari F, Cl, Br, I, At. dapat diingat dengan kalimat Fiska n Clara Baru Ingat Ateng
Golongan VI A yang terdiri dari O, S, Se, Te, Po. Dapat diingat dengan kalimat: Orang Sunda Seneng TemPo
Golongan V A yang terdiri dari N,P,As,Sb,Bi. Dapat diingat dengan kalimat : Nitra Photo Arek Anti Bisma
Golongan IVA yang terdiri dari C, Si, Ge, Sn dapat diingat dengan kalimat Cucu Simbah Geli di Sun
Golongan IIIA disebut juga golongan boron yang terdiri dari Unsur B Al Ga In Tl. Untuk memudahkan menghapal dibuatlah kalimat Bagas Al irsyadi Ganteng In Tlek
Golongan IIA disebt golongan Alkali Tanah yang terdiri dari Unsur Be, Mg, Ca, Sr, Ba, Ra. cara mennghafalnya Bebek Mangan Cacing Seret Banget Rasane
Golongan IA terdiri dari H, Li, Na, K, Rb, Cs, Fr. Untuk menghafalnya dibuat kalimat: Halinah Kawin,Rubi Cs Frustrasi
Contoh Kation dan Anion Beberapa contoh kation dan anion dapat kamu lihat pada tabel berikut ini.
Tabel: Contoh Kation dan Anion
Kation (ion positif) dan anion (ion negatif) dapat bergabung membentuk senyawa ion yang disebut senyawa ionik. Senyawa ionik dapat menghantarkan listrik.
Contoh Senyawa Ion Contoh yang paling sederhana adalah senyawa natrium klorida (NaCl) atau garam dapur yang terdiri dari ion Na+ dan ion Cl-. Ion Na+ dan ion Cl- akan tarik-menarik membentuk suatu senyawa NaCl (garam dapur) karena terdiri dari dua buah muatan listrik yang berlawanan. Untuk menguraikan senyawa NaCl ini menjadi unsur-unsur pembentuknya dapat dilakukan dengan cara mengalirkan arus listrik ke dalam lelehan natrium klorida (NaCl) sehingga NaCl ini akan terurai menjadi ion Na+ dan ion Cl-. NaCl ==> Na+ + ClNatrium Klorida Natrium + Klor (Senyawa Ionik) (Ion Natrium) (Ion Klorida)
Uji Nyala Uji warna nyala pada logam ini prinsimnya sangat sederhana, yaitu mengamati warna nyala yang dihasilkan ketika suatu senyawa logam dibakar. Pembakaran ini biasanya menggunakan api berwarna biru yang biasanya diperoleh dari pembakaran spirtus.
Teknik Analisa Uji Nyala Logam ini merupakan cara klasik dalam menganalisa senyawa, namun masih sangat efektif digunakan hingga saat ini. Selain efektif, uji nyala ini juga mamilki kelebihan yaitu murah biayanya. Alat yang digunakan dalam praktikum uji nyala logam ialah kawat nikrom(yaitu alloy nikel-kromium) ataupu kawat platina seperti pada gambar; Kawat ini digunakan karena kedua kawat tersebut tidak akan memberi warna ketika dibakar.
Dasar Teori Uji Warna Nyala Setiap unsur mempunyai ciri serta karakteristik yang berberbeda, seperti logam-logam kelompok alkali dan alkali tanah yang memberi beberapa warna yang khas jika dibakar.
Salah satu alasan warna yang khas ini muncul ialah karena konfigurasi atom-atom itu karena tiaptiap atom mempunyai konfigurasi yang berlainan dan karakteristik atau sifat-sifat khas dari kelompok itu. Warna nyala dihasilkan darireaksi kimia pergerakan elektron dalam ion-ion logam yang ada dalam senyawa. Masing-masing perpindahan elektron ini melibatkan beberapa energi dilepaskan sebagai energi sinar dengan panjang gelombang yang khas. Panjang gelombang yang spesifik inilah yang menyebabkan perbedaan warna sinar yang dihasilkan. Besarnya energi yang dihasilkan dari lompatan/perpindahan elektron ini beragam antara satu ion logam dengan ion logam lainnya. Ini berarti bahwa tiap-tiap logam akan mempunyai pola garis-garis spektrum yang berbeda dan menghasilkan warna nyala yang tidak sama pula
Prosedur Praktikum Uji Warna Nyala Prosedur uji kualitatif Nyala Logam ini sangatlah sederhana dan dapat dilakukan oleh siapapun, yaitu sebagai berikut:
1. Bersihkan sebuah kawat dengan mencelupkannya ke dalam asam hidroklorat pekat 2. Panaskan pada Bunsen. Ulangi prosedur ini sampai kawat tidak menimbulkan warna pada nyala api Bunsen. 3. Basahi kawat dengan asam dan kemudian celupkan ke dalam sedikit bubuk padatan yang akan diuji sehingga ada beberapa bubuk padatan yang menempel pada kawat tersebut. 4. Bakar kawat pada nyala Bunsen. 5. Ulangi prosedur dari awal jika warna nyala memudar